طیفسنجی فرابنفش-مرئی یکی از متداولترین تکنیکهای شناسایی و آنالیز مواد شیمیایی است که برای اندازهگیری غلظت نمونههای مجهول به صورت کمی و شناسایی کیفی ترکیبات شیمیایی استفاده میشود. از این رو پژوهشگران شیمی به فور برای پیشبرد کارهای تحقیقای خود از آن استفاده میکنند و آشنایی با اصول تئوری و دستگاهی، کاربردها، همچنین نحوه آنالیز کمی و تفسیر طیف UV-Vis برای آنها امری ضروری است.

خدمات تفسیر طیف UV-Vis
ما دادههای آنالیز UV-Vis شما را بررسی و تفسیر می کنیم.
- تفسیر طیف UV-Vis به صورت فارسی و انگلیسی
- تفسیر طیف همراه با ارائه رفرنس و مراجع معتبر
- رسم طیف UV-Vis در نرم افزار اوریجین در صورت درخواست
طیفسنجی UV-VIS (فرابنفش-مرئی)
طیفسنجی UV-VIS (فرابنفش-مرئی) یا اسپکتروفوتومتری بررسی برهمکنش نور فرابنفش و مرئی با ماده در سطوح الکترونی است. این بررسی در ناحیه ۱۸۰ نانومتر تا ۷۸۰ نانومتر طیف الکترومغناطیس انجام شده و برای آنالیز کمی و کیفی و همچنین تعیین رفتار نوری ترکیبات شیمیایی، شناسایی گونههای مختلف و اندازهگیری مقدار آنالیتهای خاص مورد استفاده قرار میگیرد. وقتی یک ترکیب شیمیایی نور را جذب میکند، برخی از فرآیندهای برانگیختگی و بازگشت به حالت اولیه در الکترونهای اتمها رخ میدهد که منجر به تولید طیف مشخص میشود که با ترسیم و تفسیر طیف مربوطه، شناسایی و آنالیز ترکیبات انجام میگیرد. ترکیبات مختلف ظرفیت جذب مختلفی داشته و باندهای جذبی متفاوتی ایجاد میکنند.

طیف الکترومغناطیس
طیف الکترومغناطیس تقسیم بندی تابش الکترومغناطیسی بر اساس انرژی، فرکانس یا طول موج فوتون است.
برهمکنش تابش و ماده
در آنالیز اسپکتروسکوپی، وقتی تابش با یک گونه شیمیایی برهمکنش میکنند، میتوانند منجر به انتقالات الکترونی در سطوح انرژی مختلف شوند. نوع انتقال بستگی به انرژی تابش و نوع برهمکنش دارد.
انتقال الکترونها همیشه از حالت پایه HOMO با انرژی پایین (بالاترین اوربیتال مولکولی پرشده) به حالت برانگیخته LUMO با انرژی بالاتر (پایینترین اوربیتال مولکولی پرنشده) رخ میدهد. مطابق نظریه اوربیتال مولکولی (MOT) ، همپوشانی اوربیتالهای اتمی سه نوع اوربیتال مولکولی را تشکیل میدهند شامل موارد زیر هستند:
- اوربیتالهای مولکولی پیوندی(Bonding molecular orbitals) با انرژی پایین.
- اوربیتالهای مولکولی ناپیوندی (Non-bonding molecular orbitals) با انرژی متوسط.
- اوربیتالهای مولکولی ضدپیوندی (Anti bonding molecular orbitals) با انرژی بالا.
انواع انتقالات الکترونیکی
وقتی یک مولکول تابش الکترومغناطیسی در ناحیه UV-visible را جذب میکند و برانگیخته میشود، الکترونهای آن از حالت پایه به حالت برانگیخته و یا از اوربیتالهای پیوندی به اوربیتال ضدپیوندی منتقل میشوند. این انتقالات شامل موارد زیر هستند:
- انتقال *𝜎 − 𝜎: انتقال الکترون از اوربیتال سیگما پیوندی (𝜎) به اوربیتال سیگما ضدپیوندی (*𝜎 ) را نشان میدهد. در ترکیباتی مانند آلکانها، همهٔ اتمها توسط پیوند سیگما به هم متصل هستند.
- انتقال *𝑛 − 𝜎 و *𝑛 − 𝜋: انتقال از اوربیتال مولکولی غیرپیوندی (𝑛) به اوربیال سیگما ضدپیوندی یا اوربیتال پی ضدپیوندی (*𝜋) را با *𝑛 − 𝜎 یا *𝑛 − 𝜋 نشان میدهند. این انتقالها نیاز به انرژی کمتری نسبت به انتقال *𝜎 − 𝜎 دارند. این انتقالات در ترکیباتی مانند آلکیل هالیدها، آلدهیدها، کتونها و غیره مشاهده میشوند.
- انتقال *𝜋 − 𝜋: این نوع انتقال معمولاً در مولکولهای اشباع نشده مانند آلکنها، آلکینها، آروماتیکها، ترکیبات کربونیل و غیره نشان داده میشود. این انتقال نیاز به انرژی کمتری نسبت به انتقال *𝑛 − 𝜎 دارد.
انتقالات الکترونیکی که بیشترین انرژی را نیاز دارند، انتقالات الکترونیکی*σ-σهستند و انتقالاتی که کمترین انرژی را نیاز دارند، انتقالات الکترونیکی *n-π هستند.
ترتیب انرژی انواع مختلف انتقال الکترونیکی به شرح زیر است.
σ-σ* > n-σ* > π-π* > n-π*
این انتقالات تحت قانون بیر-لامبرت مورد بررسی قرار گرفته میگیرند.
قانون لامبرت
قانون لامبرت نشان میدهد که میزان جذب نور تکرنگ “A” با طول مسیر (طول سل) “ℓ” رابطه مستقیم دارد. این بدان معناست که بخشهای مختلف ماده جاذب مقدار برابر از نور ورودی را جذب میکنند.
A ∝ ℓ
قانون بیر
قانون بیر نشان میدهد که جذب نور و یا تابش الکترومغناطیس با غلظت محلول رابطه مستقیم دارد. این قانون رابطه کمی بین شدت تابش و غلظت گونههای شیمیایی را مشخص میکند.
A ∝ c
قانون بیر-لامبرت
مجموع قوانین بیر و لامبرت بیان که میزان جذب’A’ یک پرتو مونوکروم، به طور مستقیم به غلظت ‘c’ محلول و طول مسیر ‘ℓ’ بستگی دارد.
A ∝ c . ℓ
A = ε . c . ℓ
که در آن،
ε ضریب جذب مولی است.
یا
ε جذب یک محلول با غلظت 1mole/dm-3 و طول مسیر 1cm است.
جذب (Absorbance)
جذب (Absorbance) نسبت شدت تابش الکترومغناطیس ورودی از منبع به شدت تابش الکترومغناطیس منعکس شده است که توسط آشکارساز تشخیص داده می شود.
نمایش ریاضی:
A = Log ℓo / ℓ
A = ε . c . ℓ
پس،
Log ℓo / ℓ = ε . c . ℓ
عبور (Transmittance)
عبور (Transmittance) برابر نسبت تابش الکترومغناطیس خارج شده از نمونه به تابش منبع نور ورودی بر روی نمونه است.
نمایش ریاضی برای عبور به صورت زیر است:
T= Pt / Po
% T = T × 100
% T = Pt / Po × 100
تبدیل جذب به عبور
A = – log T
(از آنجایی که T= Pt / Po) A = – log Pt / Po
A = log Po / Pt
A = 2- log T %
% T = antilog (2 – A)
محدودیتهای قانون لامبرت بیر
- منبع نور باید تکرنگ باشد.
- این قانون برای محلولهای غلیظ مناسب نیست، به عبارت دیگر فقط برای محلولهای رقیق استفاده میشود
- با افزایش رققت، تفکیک اسیدهای ضعیف رخ میدهد و اسیدهای ضعیف به تعادل با پایه همراه خود میرسند و اسید (HA) و پایه همراه (–A) نمیتوانند همان جذب را داشته باشند. بنابراین این قانون ب برای محلولهای اسیدی ضعیف قابل استفاده نیست.
اصول دستگاهی طیفسنجی UV-visible
ابزارهای اصلی طیفسنجی UV-vis شامل موارد زیر هستند:
- منبع نور
- انتخاب کننده طول موج
- ظرف نمونه یا کووت
- دتکتور
1. منبع نور
منابع نوری که در ناحیه فرابنفش و مرئی قرار دارند، به عنوان منابع تابش اسپکترومتر UV-Visible استفاده میشوند.
- لامپهای هیدروژن و دوتریوم که در بازه ۱۶۰-۳۸۰ نانومتر قرار دارند.
- لامپهای قوس زئون که در بازه ۲۵۰-۶۰۰ نانومتر قرار دارند.
- لامپهای تنگستن هالوژن که در بازه ۲۴۰-۲۵۰۰ نانومتر قرار دارند.
2. انتخاب کننده طول موج
اسپکتروسکوپی UV-Vis نیاز به یک طول موج تک دارد تا عملکرد صحیح و دقیق داشته باشد. در حالی که خروجی یک طول موج تک امکان پذیر نیست و به همین دلیل از یک باند تابش استفاده میشود و هرچه پهنای باند باریک باشد بهتر خواهد بود.
انواع انتخاب کنندههای طول موج شامل موارد زیر هستند:
- فیلترها
- مونوکروماتورها
فیلترها
فیلترها برای عبور یک باند خاص از طول موج استفاده میشوند. سادهترین نوع فیلتر، فیلتر جذب است و بیشتر از همه از فیلترهای شیشهای رنگی استفاده میشوند. آنها بخشی گسترده از طیف را جذب میکنند (رنگهای مکمل) و بخشهای دیگر را انتقال میدهند (رنگ خودشان).
مزایای فیلترها
- فیلترها ارزان هستند.
- از لحاظ فنی ساده هستند.
معایب فیلترها
- فیلترها فقط در ناحیه مرئی قابل استفاده هستند.
- آنها انتخاب کنندههای طول موج خوبی نیستند.
- برای اهداف تحقیقاتی مناسب نیستند زیرا پهنای باند گسترده را عبور میدهند و احتمال انحراف از قانون لامبرت بیر بیشتر است.
مونوکروماتورها
مونوکروماتور یک دستگاه نوری است که برای انتخاب یک باند باریک از طول موج نور استفاده میشود و دارای ساختار منشور کوارتز یا شبکهای است.
کاربردهای مونوکروماتورها
مونوکروماتورها برای اسکن طیفی، یعنی تغییر طول موج تابش در یک محدوده استفاده میشوند و میتوانند در ناحیه UV-Visible مورد استفاده قرار گیرند.
اجزای یک مونوکروماتور
همه مونوکروماتورها در ساخت مکانیکی مشابه هستند و اجزای اصلی آنها عبارتند از:
- شکاف
- آینه
- لنز
- شبکه / منشور
3. ظروف نمونه / سلها یا کووت
ظروف نمونه یا کووت که تصویر آنها در شکل زیر نمایش داده شده است معمولا از جنس ترکیبات زیر هستند:
- کوارتز
- بورسیلیکات
- پلاستیک
- تنها کوارتز در هر دو ناحیه UV و مرئی شفاف است (۲۰۰-۷۰۰ نانومتر).
- شیشه و پلاستیک فقط برای ناحیه مرئی مناسب هستند.
- شیشه برای ناحیه UV مناسب نیست زیرا تابش UV را جذب میکند و در این ناحیه شفاف نیست.
- سلهای پلاستیکی برای حلالهای آلی استفاده نمیشوند.
اندازه کووت
معمولاً اندازه کووت ۱ سانتیمتر است، اگرچه ممکن است از ۰.۱-۱۰ سانتیمتر متغیر باشد.
4. دتکتورها
دتکتورها یا آشکارسازها دستگاههایی هستند که وجود برخی پدیدههای فیزیکی را نشان میدهند. برخی از انواع دتکتورهای ساده عبارتند از:
- مبدلها (Transducers)
- فتودتکتورها (Photodetectors)
- فیلمهای عکاسی
- سطح جیوه در ترمومترها (تشخیص دما)
- چشم انسان
مبدلها
مبدل یک نوع خاص از دتکتور است که سیگنالهایی مانند شدت نور، pH، جرم و دما و غیره را به سیگنالهای الکتریکی تبدیل میکند. این سیگنال الکتریکی تقویت و تغییر شکل یافته و به صورت اعداد (شکل دیجیتال) نمایش داده میشوند.
ویژگیهای مبدلها
- مبدلها پاسخ سریعی به سطوح پایینی از انرژی تابشی دارند.
- برای یک دامنه گسترده از طول موجها مناسب هستند.
- سیگنالهای الکتریکی تولید شده توسط مبدلها باید نویز کمی داشته باشند.
- سیگنال تولید شده توسط مبدلها به طور مستقیم به تابش توان متناسب است.
فتودتکتورها
فتودتکتورها به عنوان موارد زیر استفاده میشوند:
- فوتولولهها
- لولههای فتومولتی پلایر
- دیودهای سیلیکون
- سلهای فتوولتائیک
فوتولولهها
فوتولولهها یا سلولهای فتو امیسیو نوعی فتودتکتور هستند. در ساختار آنها سطوح خمیده کاتدی و آندی درون یک بطری شیشهای قرار دارند. کاتد با ماده فتو امیسیو (photoemissive) مانند سریم، اکسید پتاسیم، اکسید نقره و غیره پوشش داده شده است و آند یک صفحه یا حلقه فلزی با ولتاژ بالا است. داخل بطری شیشهای نیز با گاز بیاثر در فشار کم پر شده است.
لولههای فتومولتی پلایر
لولههای فتومولتی پلایر به صورت دینودهای تکراری در زاویههای خاص ساخته میشوند. الکترونهای تولید شده بر روی دینودهای مختلف برخورد میکنند. هر دینود دارای ولتاژ بالاتری نسبت به دینودهای قبلی است. این تفاوت ولتاژ الکترونها را شتاب میدهد و با برخورد الکترونهای سریع با دینودهای بعدی الکترونهای بیشتری جمع آوری میشود.تکرار این فرآیند باعث جمعآوری تا ۱۰۶ الکترون به ازای هر فوتون که بر روی کاتد اول برخورد میکند میشود.
لولههای فتوضعیفکننده نسبت به لولههای فتو حساس و هزینهبر هستند.

انواع اسپکترومترهای UV-Vis
دو نوع اسپکتروفتومتر UV-Vis وجود دارد:
- اسپکتروفتومتر تک پرتو UV-Vis
- اسپکتروفتومتر دو پرتو UV-Vis
اسپکتروفتومتر تک پرتو UV-Visible
اسپکتروفتومتر تک پرتو UV-Visible دارای یک پرتو است، همانطور که از نام آن پیداست. نور ورودی از منبع از طریق یک مونوکروماتور عبور می کند و سپس نور تک رنگ ورودی از طریق یک شکاف وارد محلول نمونه میشود. در اینجا بخشی از نور ورودی توسط نمونه جذب می شود و بخش دیگری عبور میکند. نور عبوری توسط دتکتور تشخیص داده می شود و سپس تقویت، ضبط شده و در یک دستگاه مناسب نمایش داده می شود. در نهایت طیف رسم شده و λmax مشخص می شود.
اسپکتروفتومتر تک پرتو UV-Visible شامل موارد زیر است:
- منبع نور
- لنز
- شبکه ها
- انتخاب کننده طول موج
- ظرف نمونه / کووت
- دتکتور
- نمایشگر دیجیتالی
اسپکتروفتومتر دو پرتو UV-Visible
ابزار دقیق اسپکتروفتومترهای تک و دو پرتو تقریباً یکسان است و تفاوت اساسی آنها در این است که در اسپکتروفتومتر تک پرتو UV-Vis، نور ورودی به طور همزمان از سلول های نمونه و مرجع عبور می کند. در نهایت پرتوی نور عبوری توسط دتکتورها تشخیص داده می شود. اسپکتروفتومتر دو پرتو UV-Vis نیاز به دو دتکتور برای اندازه گیری یا محاسبه جذب در نمونه آزمایشی دارد.
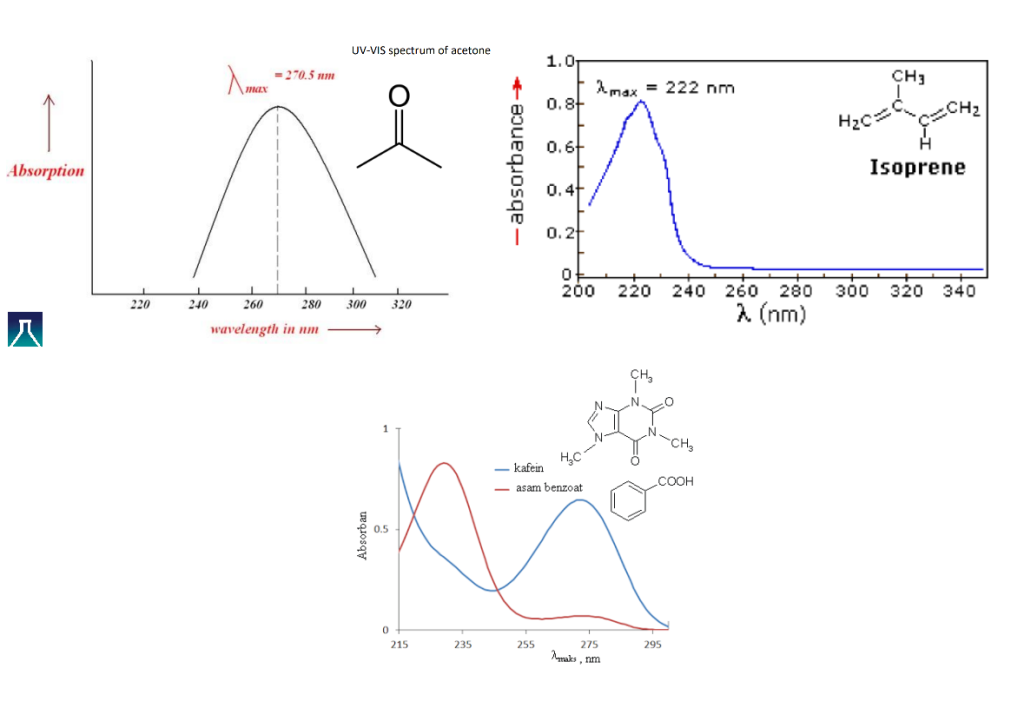
باند جذبی، جابجایی و شدت پیک در طیف UV-VIS
طیف UV-VIS به صورت یک نمودار است که میزان جذب در طول موجهای مختلف را نشان میدهد. قلههای جذب مشاهده شده به عنوان لاندا مکس (λmax) شناخته میشوند. این طیفها میتوانند برای استخراج اطلاعاتی مانند میزان خلوص و ساختار ترکیبات مورد استفاده قرار گیرند. طیفهای UV-Vis به طور متداول برای بررسی حضور گونههای شیمیایی آلی و همپیوندی دارای طول موج جذبی در این محدوده استفاده میشوند.
به عنوان مثال در تصویر زیر طیف uv-vis کلروفیل-a که عامل رنگ سبز گیاهان را مشاهده میکنید که در مناطق طول موج بنفش و نارنجی دارای جذب است ولی در ناحیه طول موج سبز جذب نداشته و بنابراین سبز دیده میشوند.
و یا آموکسی سیلین که یک آنتی بیوتیک معروف است که در طول موج حدوداً ۲۶۵ نانومتر یک قله جذبی دارد.
تجزیه و تحلیل طیفی اسپکتروسکوپی uv-vis همچنین برای تجزیه و تحلیل کمی ترکیبات نمونه استفاده می شود. جذب در طول موج خاصی از نور به طور مستقیم به غلظت توسط قانون بیر-لامبرت رابطه مستقیم دارد.
انواع جابجایی و تغییر شدت باند جذبی در طیف UV-Vis
کروموفورها (Chromophores)
کروموفورها یک اتم یا گروه از اتم ها هستند که مسئول جذب تابش uv-vis میباشند.
انواع کروموفورها
دو نوع کروموفور وجود دارد:
- کروموفورهایی که تنها شامل الکترون های π هستند و در آنها تنها انتقالات *π-π مشاهده میشود. مانند گروه اتیلیک (C=C)، گروه استیلیک (C ≡ C) و غیره.
- کروموفورهایی که دارای الکترون های π و همچنین الکترون های n (ناپیوندی) هستند. این نوع کروموفور دارای جفت الکترون های آزاد بوده و شامل دو نوع انتقال یعنی *n-π و *π-π میباشند. مانند گروه نیترو (NO2-)، گروه آزو (-N=N-)، گروه نیترو (–NO3)، گروه کربونیل ( C=O-)، گروه نیتریت (ONO-).
اکسوکرومها (Auxochromes)
اکسوکرومها یک اتم یا گروه از اتم ها هستند که باعث تغییر ویژگی های جذبی یک کروموفور می شوند اما خود باند جذبی را ایجاد نمی کند. اکسوکرومها می توانند هم شدت و هم طول موج را موقع اضافه شدن به کروموفور تغییر دهند. اکسوکرومها به عنوان گروه تقویت کننده رنگ نیز نامیده می شوند. مانند متیل (CH3-)، کلرید (Cl–)، هیدروکسیل (OH–)، آمینو (NH2-)، آلکوکسی (CH3O–) و غیره.
چهار نوع جابجایی متناظر با اکسوکرومها وجود دارد:
- جابجایی باتوکرومیک (Bathochromic shift) (جابجایی قرمز)
- جابجایی هیپسوکرومیک (Hypsochromic shift) (جابجایی آبی)
- جابجایی هایپرکرومیک (Hyperchromic shift)
- جابجایی هیپوکرومیک (Hypochromic shift)
جابجایی باتوکرومیک یا جابجایی به سمت قرمز
تغییر مکان باتوکرومیک تغییر موقعیت باند جذب به سمت طول موج بزرگتر است. این تغییر در حضور اکسوکروم یا تغییر در حلال رخ می دهد.
جابجایی هیپسوکرومیک یا تغییر به سمت آبی
تغییر مکان هیپسوکرومیک تغییر موقعیت باند طیفی به سمت طول موج کوتاهتر است. این تغییر به دلیل حذف همپیوندی یا تغییر در قطبیت حلال رخ می دهد.
جابجایی هایپرکرومیک
تغییر مکان هایپرکرومیک افزایش شدت باند جذبی مثلا εmax است. جابجایی هایپرکرومیک به دلیل حضور اکسوکروم رخ می دهد.
جابجایی هیپوکرومیک
تغییر مکان هیپوکرومیک کاهش شدت جذب مانند باند εmax است.
عوامل موثر بر تغییر در جذب و طول موج طیف UV-Vis
عواملی که تغییر در جذب و طول موج طیف UV-Vis ایجاد میکنند عبارتند از:
- تأثیر دمای نمونه
- تأثیر غلظت نمونه
- تأثیر pH نمونه
- تأثیر حلال
- تأثیر مزدوج شدن
- تأثیر حلقه آروماتیک
- تأثیر جایگزینی آکسوکروم
1. تأثیر دمای نمونه
حالتهای انرژی چرخشی و ارتعاشی به دما وابسته هستند و هنگامی که دما کاهش مییابد، حالتهای انرژی چرخشی و ارتعاشی مولکولها نیز کاهش مییابد و به دلیل توزیع کوچکتر حالتهای تحریک شده ، باندهای جذب دقیقتری تولید میشود و تیزی باندهای جذبی بیشتر میشود. همچنین با کاهش دما، موقعیت قله ماکزیمم کمی به سمت طرف موج بلندتر حرکت میکند. به منظور به دست آوردن نتایج دقیق، طیف باید در یک دمای ثابت یا خاص گرفته شود.
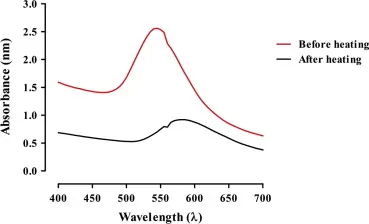
2. تأثیر غلظت نمونه
غلظت نمونه آماده شده برای اندازه گیری طیف UV-VIS به طور مستقیم با شدت جذب نور شده در ارتباط است و طیف را تحت تأثیر قرار میدهد. در غلظتهای بالا ، تعاملات مولکولی رخ میدهد که باعث تغییر شکل و موقعیت باندهای جذب میشود.
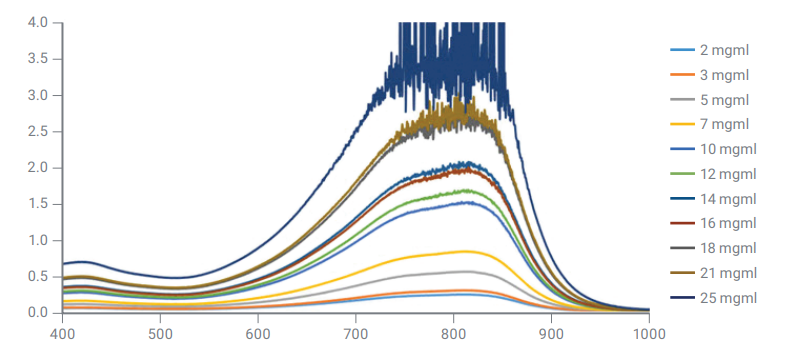
3. تأثیر pH نمونه
تغییر pH محلول بر طیف حاصل از طیف سنجی UV-Vis تاثیر دارد. اگر pH محلول تغییر کند، طیف جذبی ترکیبات آروماتیک مانند آمین ها و فنل ها نیز تغییر می کند. با حذف پروتون فنلیک، یون فنلیک به دست می آید که سیستم مزدوج را افزایش می دهد. این باعث کاهش تفاوت انرژی بین مدارهای LUMO و HOMO می شود که منجر به جابجایی به طول موج بزرگتر همراه با افزایش شدت جذب می شود.
اگر یک آمین آروماتیک در یک محیط اسیدی پروتونه شود، سیستم مزدوج مختل می شود. جابجایی قله به سمت طول موج کوتاهتر رخ می دهد و شدت پیک نیز کاهش مییابد.
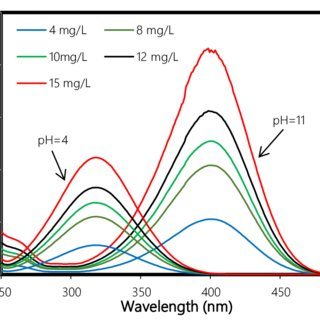
4. تأثیر قطبیت حلال
قطبیت تأثیر قابل توجهی روی موقعیت و شدت باندهای جذب دارد. این افزایش به دلیل انتقالهای *n-π و π-π* است. در حضور حلال هیدرولیتیک قطبی (مانند آب) پیوندهای هیدروژنی با جفت الکترونی اکسوکروم ایجاد میشود. به عبارتی، انرژی اکسوکروم به اندازه انرژی تشکیل پیوند کاهش مییابد و در نتیجه فاصله انرژی بین HOMO و LUMO افزایش مییابد و یک جابجایی هیپسوکرومیک برای انتقال *n-π مشاهده میشود.
برای مثال
| Absorption wavelength | Solvent | n-π* Transitions |
|---|---|---|
| 279nm | Hexane | |
| 270nm | Methanol | |
| 264nm | Water |
برای انتقال *π-π ، اوربیتال*π قطبیتر از اوربیتال π است، بنابراین در حضور حلال قطبی به میزان بیشتری پایدار میشود. این باعث یک جابهجایی باتوکرومیک میشود زیرا فاصله انرژی بین π-π* به دلیل پایداری اوربیتال*π کاهش مییابد.
| Absorption wavelength | Solvent | π-π* Transitions |
|---|---|---|
| 230 nm | Hexane | |
| 243 nm | Water |
5. تاثیر پیوند مزدوج
طبق نظریه مولکولی مدارهای مولکولی، با افزایش تعداد الکترونهای پی، پیوند مزدوج افزایش مییابد. به دلیل افزایش مزدوج شدن، مولکولهای نمونه پایدار میشوند و به حالتی با انرژی کمتر میرسند. این کاهش انرژی باعث تغییر در طول موج جذبی به سمت طول موج بالاتر میشود که به آن جابجایی قرمز میگویند.
جذب ماکزیمم ۱،۲-بوتادین در ۲۱۰ نانومتر است اما برای ۱،۳-بوتادین در ۲۱۷ نانومتر مشاهده میشود که به دلیل مزدوج شدن دو باند دوگانه است. این طول موج در ۱،۳،۵-هگزاترین به دلیل مزدوج شدن در دو نقطه به ۲۶۰ نانومتر افزایش مییابد
6.تأثیر حلقه آروماتیک
حلقه آروماتیک، به ویژه زمانی که دو یا بیشتر از حلقهها به صورت مزدوج قرار دارند (ترکیبات پلیحلقوی)، طول موج بالاتری در منطقه مرئی جذب میکند و طیف جذب را تغییر میدهد.
به عنوان مثال:
نفتالن (C6H6) در ۲۶۸ نانومتر جذب دارد.
آنتراسن در ۳۱۱ نانومتر جذب دارد.
تتراسن در ۴۷۶ نانومتر جذب دارد.
8. تأثیر جایگزینی آکسوکروم
اضافه شدن گروه قطبی به حلقه بنزن باعث افزایش λmax در منطقه مرئی و در نتیجه افزایش مقدار εmax میشود.
| ε(max) | λ(max) | Compound | Auxochrome |
|---|---|---|---|
| 250 | 256 | Benzene | — |
| 200 | 280 | Aniline | -NH2 |
| 360 | 265 | Chlorobenzene | -Cl |
کدام حلال در اسپکتروسکوپی UV استفاده میشود؟
حلال مورد استفاده در اسپکتروسکوپی UV بستگی به خصوصیات نمونه تحت آنالیز و کاربرد خاص دارد. برخی از حلالهای معمول استفاده شده در اسپکتروسکوپی UV عبارتند از:
- آب: آب اغلب به عنوان حلال در اسپکتروسکوپی UV ترکیبات قطبی مانند اسیدها، بازها و بیومولکولها استفاده میشود.
- الکلها: الکلهایی مانند متانول و اتانول به طور معمول به عنوان حلال در اسپکتروسکوپی UV ترکیبات آلی استفاده میشوند.
- استونیتریل: آستونیتریل یک حلال قطبی و بیپروتیک است که اغلب برای اسپکتروسکوپی UV ترکیبات قطبی و نمونههایی که در آب یا الکلها حل نمیشوند استفاده میشود.
- دیکلرومتان: دیکلرومتان (DCM) یک حلال غیر قطبی است که اغلب برای اسپکتروسکوپی UV ترکیبات غیر قطبی استفاده میشود.
- هگزان: هگزان نیز یک حلال غیر قطبی است که اغلب برای اسپکتروسکوپی UV ترکیبات غیر قطبی استفاده میشود.
مهم است به این نکته توجه کنیم که برخی از حلالها در ناحیه UV جذب دارند و انتخاب حلال باید با دقت انجام شود. به طور کلی، یک حلال باید در ناحیه طیفی که نمونه در آن جذب دارد، شفاف باشد.
مزایا و محدودیتهای طیف سنجی UV-Vis
مزایای طیف سنجی UV-Vis
طیف سنجی UV-Vis، مانند هر فناوری دیگری، نقاط ضعف خود را دارد. محبوبیت این تکنیک به دلیل مزایای قابل توجه آن است که در زیر آورده شده است.
- چند منظوره بودن: طیف سنجی UV-Vis میتواند برای مطالعه نمونههای متنوعی در حالتهای مختلف مانند محلولها، ترکیبات دیسپرس شده و امولسیونها استفاده کرد.
- غیرمخرب بودن: این روش غیرمخرب است و به نمونه اجازه میدهد مجدداً استفاده شود یا برای پردازش و آنالیز بیشتر مورد استفاده قرار گیرد.
- سرعت بالا: اندازهگیریهای سریع امکان یکپارچهسازی ساده در روشهای آزمایشگاهی را فراهم میکند.
- حساسیت بالا: طیف سنجی UV-Vis یک تکنیک بسیار حساس است که حتی ترکیبات بسیار کم از یک ماده را در نمونه تشخیص میدهد.
- سادگی استفاده: ابزارهای این تکنیک در عمل بسیار ساده بوده و نیاز به آموزش حداقلی قبل از استفاده دارند.
- قابلیت آنالیز کمی: طیف سنجی UV-Vis میتواند برای تعیین غلظت یک ماده در نمونه استفاده شود
- هزینه کم: تجهیزات طیف سنجی UV-Vis هزینه نسبتاً کمی دارند و استفاده و نگهداری آنها آسان است.
- دسترسی گسترده: طیف سنجی UV-Vis در آزمایشگاههای تحقیقاتی و صنعتی به طور گستردهای در دسترس است، که آن را برای مجموعه گستردهای از کاربردها قابل دسترس میکند.
- رزولوشن بالا: طیف سنجی UV-Vis میتواند برای مطالعه نمونهها با رزولوشن بالا استفاده شود که این امر امکان تجزیه و تحلیل دقیق نمونه را فراهم میکند.
- گستردگی کاربردها: طیف سنجی UV-Vis دارای مجموعه گستردهای از کاربردها در شیمی تجزیه، بیوشیمی، علوم مواد و در صنایعی مانند داروسازی، غذا، آب و تجزیه و تحلیل محیطی و غیره است.
محدودیتهای طیف سنجی UV-Vis
اگرچه مزایای این روش بسیار زیاد است، اما برخی نقاط ضعف نیز در این طیف سنجی وجود دارند:
- خطای دستگاهی: در ابزار عملی این تکنیک، انتخاب کننده طول موج دقیق نیست و مقدار کمی از طیف گستردهطول موجها ممکن است از منبع نور منتشر شود که منجر به خطاهای قابل توجه در اندازهگیری شوند.
- پراکندگی نور: ذرات معلق در نمونههای مایع اغلب باعث پراکندگی نور میشوند که میتواند منجر به خطاهای قابل توجه در اندازهگیری شود. حضور حبابها در کووت یا نمونه، نور را پراکنده میکند و منجر به نتایج غیر قابل تکرار میشود.
- تداخل از چندین گونه جذب کننده: ممکن است نمونه شامل انواع مختلفی از پیگمنت سبز کلروفیل باشند که در اینصورت طیف آنها با هم تداخل خواهد داشت. برای تجزیه و تحلیل کمی دقیق، هر گونه شیمیایی باید از نمونه استخراج شده و به صورت جداگانه تجزیه و تحلیل شود.
- تداخل: طیف سنجی UV-Vis ممکن است تحت تأثیر تداخلاتی مانند پراکندگی نور و فلورسانس قرار گیرد که میتواند منجر به دستیابی نتایج غیردقیق شود.
- آمادهسازی نمونه: برخی از نمونهها نیاز به آمادهسازی یا کاربرد خاص قبل از تجزیه و تحلیل با استفاده از طیف سنجی UV-Vis دارند که ممکن است زمانبر باشد.
- محدود به گروههای عملکردی خاص: طیف سنجی UV-Vis حساس به گروههای عملکردی خاصی مانند پیوندهای دوگانه و حلقههای آروماتیک است که این امر توانایی آن را در تشخیص سایر گروههای عملکردی محدود میکند.
- نمونههای پیچیده: طیف سنجی UV-Vis ممکن است هنگام آنالیز نمونههای پیچیده مانند نمونههای بیولوژیکی شامل چندین مولکول که در یک طول موج نور جذب میکنند، پیچیدگی داشته باشد.
- محدود به نمونههای شفاف: طیف سنجی UV-Vis نیازمند این است که نمونه در طول موجهای مورد نظر شفاف باشد و برای نمونههایی که غیرشفاف یا بسیار رنگی هستند مناسب نیست.
- نیاز به مهارت بالا جهت تفسیر طیف: طیف سنجی UV-Vis نیازمند مهارت بالا برای عملکرد و تفسیر نتایج است که ممکن است برای برخی از افراد میسر نباشد.
کاربردهای اسپکتروسکوپی UV-Vis
هدف اصلی طیفسنجی UV تعیین ویژگیهای جذب یا انتقال یک نمونه در ناحیه فرابنفش (UV) طیف الکترومغناطیسی است. با اندازه گیری میزان جذب نور توسط یک نمونه در طول موج های مختلف، محققان می توانند در مورد ترکیب شیمیایی، ساختار الکترونیکی و سایر خواص آن اطلاعات کسب کنند. طیف سنجی UV در طیف گسترده ای از کاربردها استفاده می شود، از جمله:
- شیمی تجزیه: طیفسنجی UV-Vis برای تعیین غلظت یک ماده در نمونه، شناسایی ترکیبات ناشناخته و نظارت بر واکنشهای شیمیایی استفاده میشود.
- بیوشیمی: طیفسنجی UV-Vis برای مطالعه ساختار و عملکرد بیومولکولها مانند پروتئینها، اسیدهای نوکلئیک و رنگدانهها استفاده میشود.
- محیط زیست: طیفسنجی UV-Vis برای نظارت بر کیفیت آب و هوا، شناسایی آلایندهها و مطالعه فوتوشیمی گازهای جوی استفاده میشود.
- صنعت غذا: طیفسنجی UV-Vis برای اندازهگیری غلظت مواد غذایی، نظارت بر کیفیت محصولات غذایی و شناسایی آلودگیها استفاده میشود.
- علم مواد: طیفسنجی UV-Vis برای مطالعه خواص الکترونیکی و نوری مواد مانند نیمهرساناها، رنگدانهها و رنگدانهها استفاده میشود.
- شیمی آلی: طیفسنجی UV-Vis برای مطالعه ساختار الکترونیکی مولکولهای آلی، شناسایی گروههای عملکردی و مطالعه مکانیزم و سنیتیک واکنشهای شیمیایی استفاده میشود.
- تحقیقات بیولوژیکی: طیفسنجی UV-Vis برای مطالعه خواص خون، نظارت بر سطح گلوکز در خون و مطالعه فوتوشیمی سیستمهای زیستی استفاده میشود.
- پزشکی قانونی: طیفسنجی UV-Vis برای تجزیه و تحلیل شواهد ردیابی مانند الیاف و رنگ، شناسایی منبع نمونه استفاده میشود.
- فرآیند صنعتی: طیفسنجی UV-Vis برای نظارت بر پیشرفت واکنشهای شیمیایی در فرآیندهای صنعتی، بهینهسازی شرایط و کنترل کیفیت محصول نهایی استفاده میشود.
چه اطلاعاتی را می توان از طیف UV-vis بدست آورد؟
کاربردهای طیف سنجی UV-Vis به دو دسته کاربردهای کمی و کیفی تقسیم میشوند. کاربردهای کمی به منظور اندازه گیری کمی ترکیبات موجود در نمونه و کاربردهای کیفی برای تعیین گروههای عاملی و پیوندهای موجود در نمونه استفاده میشود.
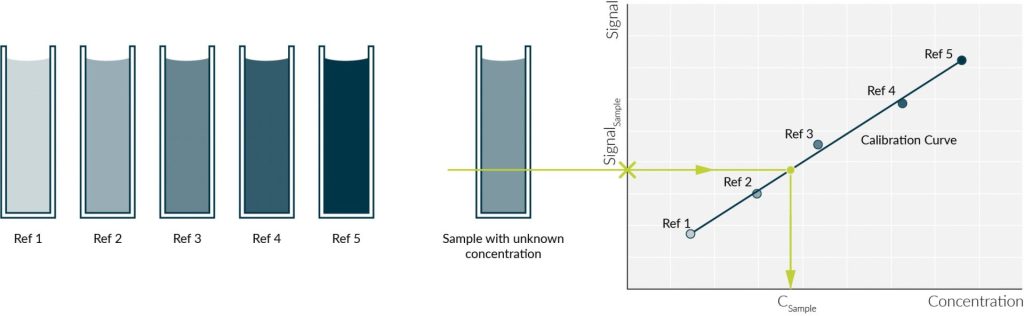
اندازه گیری کمی در طیف سنجی UV-Vis
اساس اندازه گیری کمی در طیف سنجی UV-Vis قانون بیرلامبرت است. همانطوری که اشاره شد طبق این قانون میزان جذب نور با غلظت و طول مسیر نوی متناسب است و میزان جذب رابطه خطی با غلظت نمونه دارد. بنابراین با اندازهگیری میزان جذب در غلظتهای مختلف و ترسیم نمودار کالیبراسیون میتوان غلظتهای مجهول نمونه را شناسایی کرد. منحنی کالیبراسیون میزان جذب بر حسب غلظت نمونه است که معمولا به صورت رابطه خطی است. برای رسم این منجنی حداقل 3 غلظت معلوم از نمونه به عنوان رفرنس تهیه شده و میزان جذب آنها ثبت میشود. سپس نمودار جذب آنها بر اساس غلظت ترسیم شده و با بدست آوردن معادله خط مربوط به نمونه و جایگزینی، مقدار جذب نمونه مجهول بدست میآید.
ما روی داده های شما کار می کنیم تا اطلاعات مفید را استخراج و تفسیر کنیم!
چرا ما را انتخاب کنید؟
پشتیبانی 24 ساعته در 7 روز هفته
تجزیه و تحلیل دقیق توسط متخصصین
تضمین کیفیت و رضایت
بازبینی رایگان پس از تکمیل سفارشات
قیمت مناسب
تفسیر طیف UV-Vis
طیف UV-VIS اطلاعات مهمی درباره ساختار یک ترکیب از جمله شناسایی گروههای کربونیل، پیوندهای دوگانه، سیستمهای آروماتیک و سایر کروموفورهای مهم را ارائه میدهد. این تکنیک معمولا در ترکیب با طیفسنجی IR و NMR مورد استفاده قرار میگیرد. شش مرحله اصلی در تفسیر طیف UV-VIS وجود دارد و تعیین ساختار یک ترکیب از دادههای طیفی UV-VIS به روش زیر انجام میشود:
مرحله ۱: الگوی کلی طیف را در نظر بگیرید. معمولاً برای هر طیف، هر ترکیب الگوی باند مشخصی دارد و به راحتی قابل تشخیص است.
مرحله ۲: تعداد و شدت باندهای جذبی ظاهر شده را شناسایی کنید. تعداد باندهای جذب نشاندهنده تعداد کروموفور موجود در ترکیب نمونه است. البته امکان دارد برای یک نوع کروموفور بیش از یک باند جذب وجود داشته باشد.
مرحله ۳: شدت جذب و طول موج باند جذبی را برای پیکها در نظر بگیرید. مقدار ε در تعیین ساختار مرتبط با انتقالات الکترونی مجاز مهم است و نشان دهنده کروموفورهای نمونه است. مقدار ε و محدوده طول موج برای هر کروموفور مشخص و ویژه است.
مرحله ۴: کروموفورها را با استفاده از باندهای جذبی مشاهده شده شناسایی کنید. هر کروموفور شناسایی شده الگوی طیف UV-VIS مشخص خود را دارد. برخی از مشخصات جذبی این کروموفورها در جدول زیر نشان داده شده است.
| (نوع انتقالات) Transition | εmax | λmax (nm) | (کروموفورها) Chromophores |
|---|---|---|---|
| *π → π | 13000 | 177 | Alkene |
| *π → π | 10000-160 | 178-225 | Alkyne |
| *n → σ | 1000 | 186-280 | Carbonyl |
| *n → π | 41 | 204 | Carboxyl |
| *n → π | 60 | 214 | Amido |
| *n → π | 5 | 339 | Azo |
| *n → π | 22 | 280 | Nitro |
| *n → π | 100-20 | 300-665 | Nitroso |
| *n → π | 12 | 270 | Nitrate |
| *n → π | 21000 | 282 | Ketones |
| *n → σ | 24 | 167 | H2O |
| *n → σ | 1480 | 184 | Methanol |
| *n → σ | 15 | 173 | Methyl Chloride |
| *n → σ | 200 | 184 | Dimethyleter |
| *n → σ | 2500 | 215 | Methylamine |
| *π → π | 900 | 204 | Benzene |
| *π → π | 7000 | 207 | Toluene |
| *π → π | 6200 | 211 | Phenol |
مرحله ۵: جابجایی/تغییر در باند جذب مشاهده شده را در نظر بگیرید. گروههای متصل به ساختار کروموفور میتوانند موقعیت و شدت باند جذب کروموفور را تغییر دهند که به آنها آکسوکروم گفته میشود و شامل متیل، هیدروکسیل، آلوکسی، هالوژن و گروههای آمینی هستند. چهار نوع جابجایی وجود دارد که میتواند بر جذب یک کروموفور تأثیر بگذارد که شامل جابجایی باتوکرومیک (انتقال حداکثر جذب به طول موج بلندتر یا انرژی پایینتر از آبی به قرمز)، هیپسوکرومیک (انتقال حداکثر جذب از قرمز به فرابنفش در طول موج کوتاهتر یا انرژی بالاتر)، هیپرکرومیک ( افزایش شدت جذب) و هیپوکرومیک (کاهش شدت جذب) است که قبل تر مورد بررسی قرار گرفتند.
مرحله ۶: طیف به دست آمده را با ترکیبات احتمالی تطبیق دهید.
نتیجه گیری
در این مقاله ما به اصول تئوری و دستگاهی طیف سنجی فرابنفش-مرئی پرداختیم و کاربردها و چگونگی اندازهگیری کمی و تفسیر طیف UV-Vis را بررسی کردیم. امیدواریم از خواندن این مقاله لذت برده باشید! لطفا نظرات و سوالات احتمالی خود را با ما در میان بگذارید. ما مشتاقانه منتظر شنیدن نظرات شما و غنی کردن این مبحث هستیم.
مراجع
- https://www.agilent.com/cs/library/primers/public/primer-uv-vis-basics-5980-1397en-agilent.pdf
- https://pdfs.semanticscholar.org/0fb8/c0a46e301a2217219ff79e52552a1052c895.pdf
- Mistry, B. D. “A handbook of spectroscopic data—chemistry (UV, IR, PRM, 13CNMR and Mass Spectroscopy).” Jaipur, India (2009).
- Workman Jr, Jerry, ed. The handbook of organic compounds, three-volume set: Nir, ir, r, and uv-vis spectra featuring polymers and surfactants. Elsevier, 2000.
- Ferguson, Lloyd. “Interpretation of the ultraviolet spectra of natural products (Scott, AI).” (1965): A62.
- Pretsch, Ernö, Thomas Clerc, Joseph Seibl, and Wilhelm Simon. Tables of spectral data for structure determination of organic compounds. Springer Science & Business Media, 2013.
- Perkampus, Heinz-Helmut. UV-VIS Spectroscopy and its Applications. Springer Science & Business Media, 2013.
- Harris DC. Quantitative Chemical Analysis. 7th ed, 3rd printing. W. H. Freeman; 2007.
- Diffey BL. Sources and measurement of ultraviolet radiation. Methods. 2002;28(1):4-13. doi:10.1016/S1046-2023(02)00204-9
- Namioka T. Diffraction Gratings. In: Vacuum Ultraviolet Spectroscopy. Vol 1. Experimental Methods in Physical Sciences. Elsevier; 2000:347-377. doi:10.1016/B978-012617560-8/50018-9
- https://jascoinc.com/learning-center/theory/spectroscopy/uv-vis-spectroscopy/
- https://www.technologynetworks.com/analysis/articles/uv-vis-spectroscopy-principle-strengths-and-limitations-and-applications-349865
ما داده های خام به دست آمده از آنالیزهای زیر را بررسی و تفسیر میکنیم:

طیفسنجی مادون قرمز تبدیل فوریه (FT-IR)
آنالیز عنصری (…,ICP, CHN, XRF, EDAX)
آنالیز وزنی حرارتی (TGA)
مغناطیس سنج نمونه ارتعاشی (VSM)
میکروسکوپ الکترونی روبشی (SEM)
میکروسکوپ الکترونی عبوری (TEM)
برای تفسیر طیف UV-Vis نیاز به کمک دارید؟
برای ثبت سفارش و یا دریافت مشاوره رایگان باما در ارتباط باشید
09398565101 (تماس در ساعات اداری، تلگرام یا واتساپ)


بسیار عالی ممنون
خسته نباشید
متشکرم. موفق باشید 🌺
سلام بسیار کامل و عالی
🙏🌺
سلام
بهترین ارتفاع برای نور uv که نمونه اسپیرولینا زیر آن به خوبی رشد کند چیست؟
سلام. این مسئله بستگی به شرایط و قدرت لامپ UV داره. در مقالات و مراجع بررسی بفرمایید.