یکی از سوالاتی که دانشجویان شیمی همیشه با آن مواجه هستند این است که جرم اتمی چیست؟ چگونه میتوان جرم اتم ها را اندازهگیری کرد؟ amu چه معنایی دارد؟ جرم اتمی میانگین ترکیبات مختلف چگونه محاسبه میشود؟ و اصطلاح جرم اتمی نسبی چه موقع به کار میرود؟و یا جرم اتمی چه تفاوتی با عدد جرمی دارد؟ ما در این مقاله سعی میکنیم تا به این سوالات پاسخ دهیم و شما را با مفاهیم مربوط به جرم اتمی آشنا کنیم. پس با ما همراه باشید.
جرم اتمی یکی از اساسی ترین و کاربردی ترین مفاهیم شیمی است و همیشه سوالات بسیار زیادی در مورد مفهوم و محاسبات مربوط به آن مطرح میشود. جرم اتمی به صورت مجموع جرم اجزای سازنده اتم (شامل الکترونها، پروتونها و نوترونها) تعریف میشود. با استفاده از جرم اتمی می توان تعداد اتم ها و یا مولهای موجود در مقدار مشخصی از یک نمونه را تعیین کرد. شیمیدان ها همیشه با جرم اتمی سروکار دارند و از آن برای تعیین مقدار ماده مورد نیاز برای انجام یک واکنش شیمیایی استفاده میکنند. با ما همراه باشید تا با جرم اتمی و مفاهیم مرتبط با آن آشنا شوید.
جرم اتمی(Atomic Mass) چیست و چگونه بیان میشود؟
جرم اتمی یا جرم یک اتم برابر مجموع جرم تمام الکترون ها ، پروتون ها و نوترون های موجود در آن اتم است. اتم ها از هسته (شامل پروتونها و نوترونها) و الکترون هایی که اطراف هسته قرار دارند، تشکیل شده است. اتم های هیدروژن ساده ترین نوع اتمها هستند و از یک پروتون و یک الکترون تشکیل شدهاند.
![]()
که در آن:
ma: جرم یک اتم
Me: جرم یک الکترون
Mp: جرم یک پروتون
Mn: جرم یک نوترون
Ne: تعداد الکترونهای یک اتم
Np : تعداد پروتونهای یک اتم
Nn: تعداد نوترونهای یک اتم است.
- از آنجا که جرم پروتون بیش از 1000 برابر جرم یک الکترون است ، می توان جرم الکترون را نادیده گرفت و جرم اتمی را حاصل جمع جرم تمام پروتون ها و نوترون های یک اتم عنوان کرد.
![]()
![]()
- به عنوان مثال ، اتم لیتیوم 7 را در نظر بگیرید که دارای 3 الکترون ، 3 پروتون و 4 نوترون است در این صورت جرم اتمی لیتیم برابر است با:
![]()
واحد جرم اتمی (atomic mass unit) چیست؟

واحد جرم اتمی (به افتخار بیانگذار تئوری اتمی دالتون ) “دالتون” نامیده شده و با نماد (amu) و یا u نمایش داده میشود. مقدار عددی دالتون به طور تقریبی برابر با یک دوازدهم جرم یک اتم کربن (C-12) است.

با مفهوم جرم اتمی میانگین (Average Atomic Mass) آشنا شوید

جرم اتمی میانگین به صورت میانگین جرم ایزوتوپ ها محاسبه میشود و به عنوان جرم اتمی متوسط بیان میشود. بیشتر عناصر دارای دو یا چند ایزوتوپ طبیعی هستند. ایزوتوپ ها، اتم های یک عنصر با جرم اتمی متفاوت هستندو با توجه به فراوانی نسبی (درصد) مورد بررسی قرار میگیرند. . جرمی که در در جدول تناوبی برای عناصر ذکر شده نیز جرم اتمی متوسط است. اگر عنصری فقط یک ایزوتوپ داشته باشد جرم اتمی و جرم اتمی آن یکسان خواهد بود.
محاسبه جرم اتمی میانگین ایزوتوپ ها (Average Atomic Mass)
با استفاده از فرمول زیر میتوان جرم اتمی میانگین را محاسبه کرد: mi جرم اتمی و pi فراوانی نسبی ایزوتوپ است.
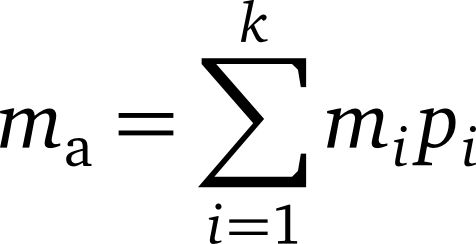
به عنوان مثال جرم اتمی کربن، هیدروژن، کلر و اکسیژن به صورت زیر محاسبه میشود:
محاسبه جرم اتمی میانگین کربن
کربن دارای سه ایزوتوپ طبیعی است. درصد فراوانی نسبی و جرم اتمی هر کدام از ایزوتوپ های کربن به صورت زیر است:
ایزوتوپ | فراوانی نسبی(%) | جرم اتمی(u) |
12C | 98.892 | 12 |
13C | 1.108 | 13.00335 |
14C | < 10−12 | 14.000317 |
با جایگزینی فراوانی نسبی و جرم هر کدام از ایزوتوپهای کربن میتوان جرم اتمی کربن را محاسبه کرد:

محاسبه جرم اتمی میانگین هیدروژن
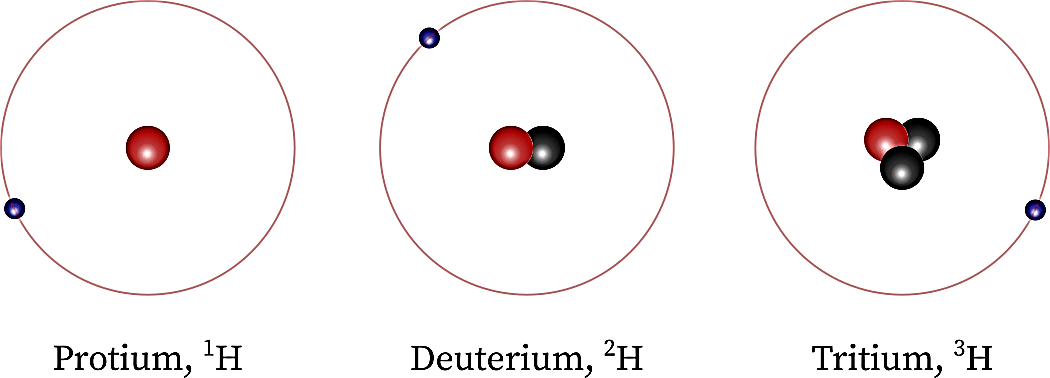
برای محاسبه جرم اتمی هیدروژن ابتدا بایستی ایزوتوپهایی هیدروژن و جرم اتمی و درصد فراوانی هرکدام از ایزوتوپ ها را مشخص کنید:
- هیدروژن دارای سه ایزوتوپ (Isotope) به نامهای پروتیومprotium (11H) ، دوتریم (deuterium (21H و تریتیوم tritium (31H) است.
- جرم اتمی (Atomic Mass) و درصد فراوانی (Abundance) هرکدام از آنها در جدول زیر آورده شده است:
ایزوتوپ | جرم اتمی (u) | فراوانی (%) |
Protium | 1.007 825 | 99.988 5 |
Deuterium | 2.014 101 | 0.011 5 |
Tritium | 3.016 049 | Trace (بسیار کم) |
با جایگذاری جرم اتمی و درصد فراوانی هر کدام از ایزوتوپهای هیدروژن در فرمول جرم اتمی میانگین، جرم اتمی هیدروژن برابر 1.008u به دست میآید.

محاسبه جرم اتمی میانگین کلر
- کلر دارای دو ایزوتوپ است. درصد فراوانی Abundance (%) و جرم اتمی Atomic Mass (u) ایزوتوپهای کلر به صورت زیر است:
ایزوتوپ | جرم اتمی(u) | فراوانی(%) |
Chlorine-35 | 34.968853 | 76 |
Chlorine-37 | 36.965903 | 24 |
- اگر جرم اتمی و فراوانی هر کدام از ایزوتوپهای کلر را در فرمول جرم اتمی میانگین جایگذاری کنیم، جرم اتمی کلر به صورت زیر محاسبه میشود:
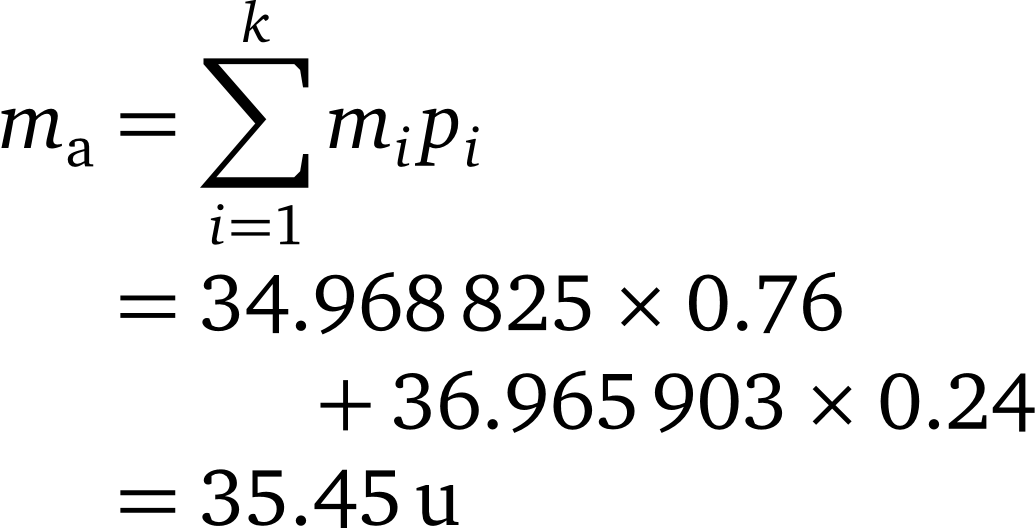
محاسبه جرم اتمی اکسیژن
اکسیژن دارای 3 ایزوتوپ oxygen-16 ()،oxygen-17 () و oxygen-18 ()است. درصد فراوانی و جرم اتمی هر کدام از ایزوتوپهای اکسیژن در جدول زیر ذکر شده است:
ایزوتوپ | جرم اتمی (u) | فراوانی (%) |
Oxygen-16 | 15.994915 | 99.76 |
Oxygen-17 | 16.999131 | 0.04 |
Oxygen-18 | 17.999160 | 0.20 |
با جایگزینی داده ها در فرمول جرم اتمی میانگین جرم اتمی میانگین اکسیژن برابر 15.999 u به دست میآید:
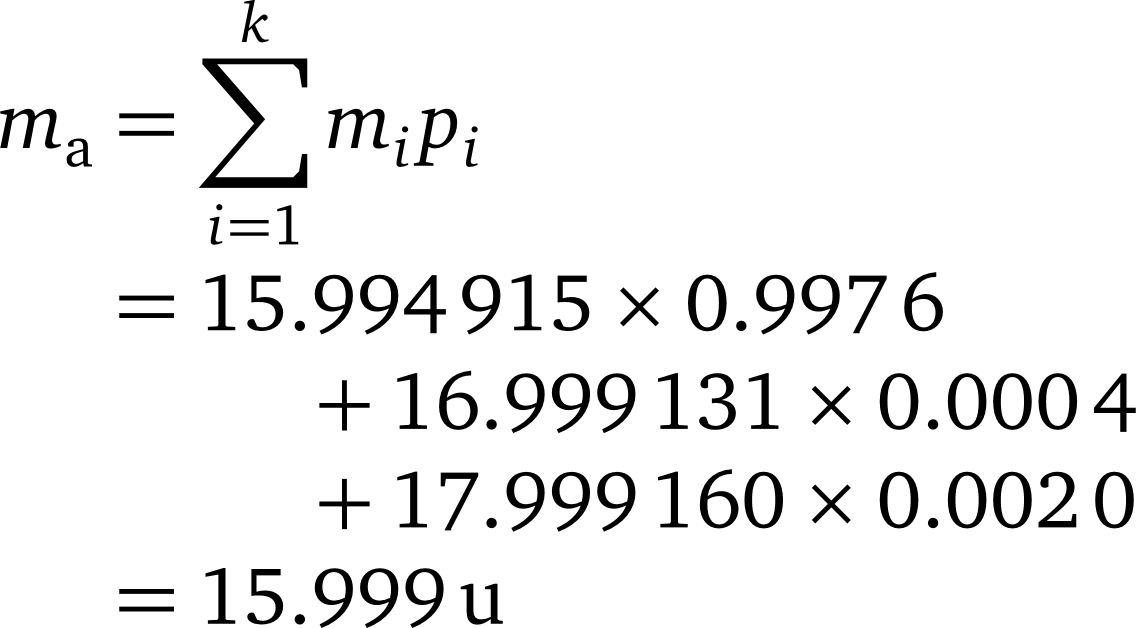
جرم اتمی نسبی یا وزن اتمی متوسط (Relative Atomic Mass or Atomic Weight)

جرم نسبی عناصر برای ساده سازی روند کار کردن با جرم یک اتم یا یک مولکول مورد استفاده قرار میگیرد. جرم اتمی نسبی یک کمیت فیزیکی بدون واحد است و به صورت نسبت جرم اتمهای یک عنصر شیمیایی به یک دوازدهم جرم اتم کربن -12 تعریف می شود. جرم اتمی نسبی نشان میدهد که جرم یک اتم چقدر از یک دوازدهم جرم کربن 12 بیشتر است. به عنوان مثال جرم اتم منیزیم دو برابر جرم اتم کربن و 24 برابر جرم اتم هیدروژن است و یا جرم اتم های هیدروژن 12 برابر کمتر از اتم کربن است.
کاستی جرم (Mass Defect) چیست؟

نقص جرم، تفاوت بین مجموع جرمهای تمام اجزای سازنده و جرم اتمی به مشاهده شده برای یک عنصر است. این موضوع اولین بار توسط انیشتین کشف شد. هنگامی که یک اتم از تمام ذرات تشکیل دهنده آن (الکترون ، پروتون و نوترون) تشکیل می شود ، مقداری از جرم به انرژی بستگی هسته تبدیل میشود. به همین دلیل، جرم مشاهده شده یک اتم از مجموع جرم ذرات سازنده آن کمتر است. البته میزان این کاهش نسبت به جرم اتمی، مقدار ناچیزی است.
روش اندازه گیری جرم اتمی

از آنجا که اتم ها بسیار کوچک هستند، جرم آنها نیز بسیار کم است. اندازه گیری جرم یک اتم با ترازوهای معمولی امکان پذیر نیست. امروزه با استفاده از تکنولوژی و ابزارهای قدرتمند مانند طیف سنجی جرمی (mass spectrometer) میتوان جرم یک اتم را با دقت بالایی اندازه گیری کرد. طیف سنج جرمی وسیله ای بسیار قدرتمند برای شناسایی عناصر ، ایزوتوپ ها و ترکیبات مختلف است.
طرز کار طیف سنج جرمی (mass spectrometer)
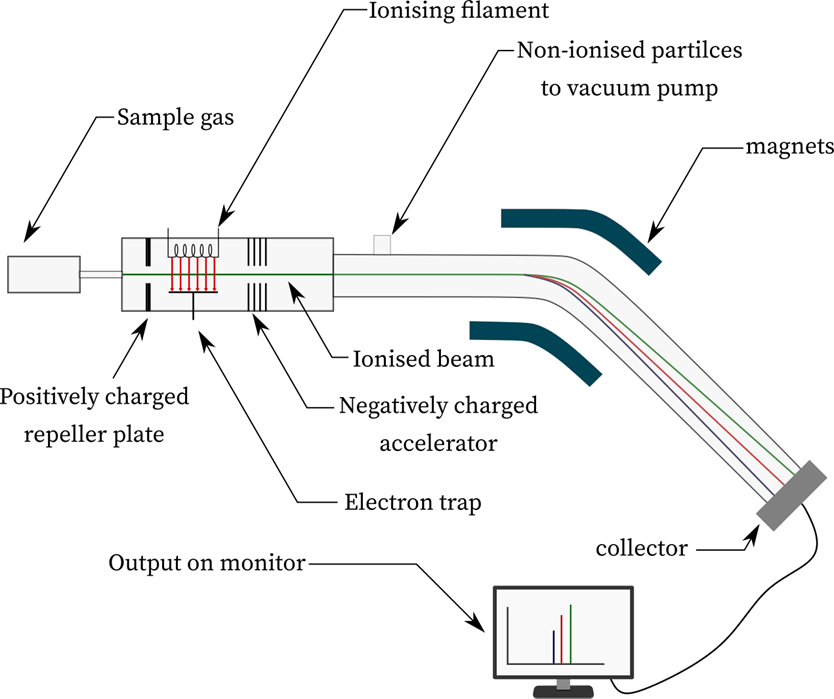
- به منظور بررسی نحوه کار طیف سنج جرمی به صورت خلاصه می توان گفت: طیف سنج جرمی نمونه های گازی را آنالیز کرده و از نسبت جرم به بار برای تعیین جرم یک اتم استفاده میکند.
- یک طیف سنج جرمی به سه قسمت اصلی منبع یونی (ion source) ، آنالیزکننده جرم (mass analyser) و آشکارساز (detector) تقسیم میشود
- فلامنت یونیزه کننده منجر به جدا شدن الکترونها از نمونه گازی و به عبارت دیگر یونیزه شدن آن میشود. آنالیزگر جرمی، یونها را بر اساس نسبت جرم به بار جدا می کند (جدا شدن یونها با با قرار دادن نمونه در یک میدان مغناطیسی و انحراف نمونه از مسیر عادی حاصل می شود) و در نهایت این انحرافات توسط دتکتور جمع آوری و تجزیه و تحلیل می شود و خروجی حاصل بر روی مانیتور نشان داده میشود.
- کارکرد طیف سنجی جرمی با تزریق نمونه شروع می شود. نمونه تزریق شده از صفحات دارای بار مثبت عبور کرده و در یونیزه شده و به یون تبدیل میشود. پس از یونیزاسیون، نمونه از یک شتاب دهنده دارای بار مثبت عبور کرده و در معرض آنالیزگر جرمی قرار میگیرد و تحت تأثیر یک میدان مغناطیسی منحرف می شود. میزان ین انحراف به نسبت جرم به بار (mass to charge ratio) بستگی دارد. به عنوان مثال، ذرات سنگین تر در مقایسه با ذرات سبک تر انحراف کمتری دارند.
تاریخچه جرم اتمی

- تاریخچه جرم اتمی به اوایل قرن نوزدهم زمانی که جان دالتون نظریه اتمی را ارائه کرد، برمی گردد. دالتون اولین شیمی دان بود که جرم اتمی نسبی را تعیین کرد. او هیدروژن را به عنوان عنصر مرجع تعیین کرد. جرم اتمی نسبی اختصاص داده شده به هیدروژن برابر 1 بود.
- حدود سال 1900 ، اکسیژن به جای هیدروژن به عنوان عنصر مرجع جایگزین شده و واحد جرم اتمی در آن زمان به عنوان جرم یک شانزدهم اتم اکسیژن تعریف شد. بعداً مشخص شد که اکسیژن دارای دو ایزوتوپ سنگین تر ( و ) است. چون وجود ایزوتوپ های اکسیژن در تعریف جرم اتمی گنجانیده نشده بود، اکسیژن با کربن 12 جایگزین گردید و تا به امروز ، کربن (C-12) به عنوان عنصر مرجع برای جرم اتمی باقی مانده است
فرق جرم اتمی (Atomic Mass) و عدد جرمی (Mass Number) چیست؟
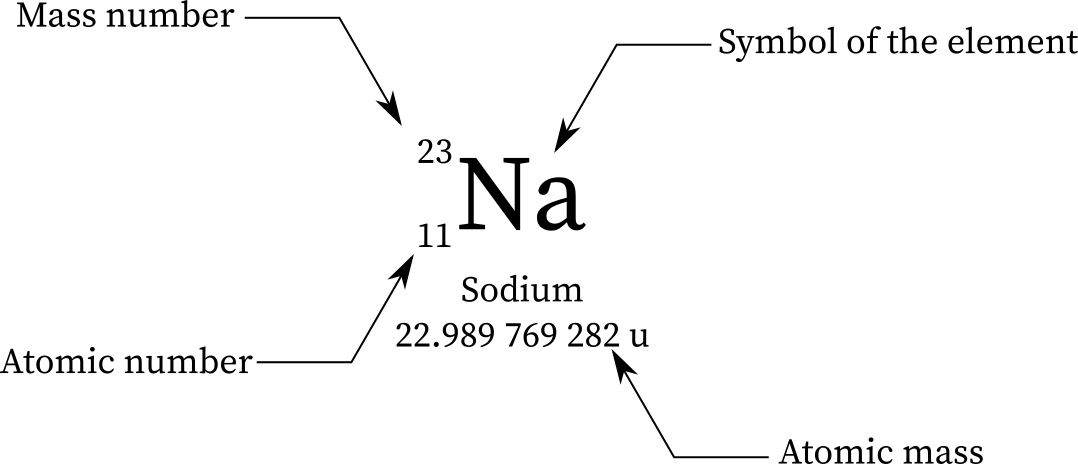
جرم اتمی و تعداد جرم دو مقدار متفاوت هستند. جرم اتمی مجموع جرم تمام پروتون ها و نوترون های یک اتم است ولی عدد جرمی تعداد نوکلئون ها (پروتون ها و نوترون ها) یک اتم را نشان میدهد. عدد جرمی برخلاف جرم اتمی یک عدد صحیح است.
عنصر | جرم اتمی, u | عدد اتمی, A | mu∕A |
1 | 1.008 | 1 | 1.008 |
4 | 4.003 | 4 | 1.001 |
12 | 12 | 12 | 1 |
16 | 15.995 | 16 | 0.999 69 |
56 | 55.935 | 56 | 0.998 84 |
233 | 233.048 | 233 | 1.045 06 |
238 | 238.051 | 238 | 1.000 21 |
نتیجه گیری
- جرم اتمی حاصل جمع جرم تمام پروتون ها و نوترون های یک اتم است.
- برای بیان جرم اتمی عناصر از واحد جرم اتمی (amu) استفاده میشود. 1amu برابر با یک دوازدهم جرم یک اتم کربن (C-12) است و مقدار عددی آن طور تقریبی برابرkg است.
- جرم اتمی میانگین وزن متوسط تمام اتمهای یک عنصر بر اساس فراوانی ایزوتوپهای آن است.
- جرم اتمی نسبی یک کمیت فیزیکی بدون واحد است و به صورت نسبت جرم اتمهای یک عنصر شیمیایی به یک دوازدهم جرم اتم کربن (C-12) تعریف می شود.
- قانون کاستی جرم بیان میکند که جرم مشاهده شده یک اتم از مجموع جرم ذرات سازنده آن کمتر است.
- توسط طیف سنجی جرمی میتوان جرم یک اتم را با دقت بالایی اندازه گیری کرد.
- جرم اتمی مجموع جرم تمام پروتون ها و نوترون های یک اتم است ولی عدد جرمی تعداد نوکلئون ها (پروتون ها و نوترون ها) یک اتم را نشان میدهد و با نماد A نمایش داده میشود.
لطفا نظرات و سوالات خود را از طریق بخش نظرات با ما در میان بگذارید. مطمئن باشید نظرات شما برای ما و دیگر کاربران بسیار با ارزش خواهد بود.


بسیار عالی ومفید
خیلی کامل و مفید🌹
___
مقدار عددی دالتون به طور تقریبی برابر 1kg است. این عدد برابر با یک دوازدهم جرم یک اتم کربن (C-12) است.
توی این قسمت منظور از 1kg یک و شصت شش صدم ضبدر ده به توان منفی بیست و هفته؟
خواهش میکنم. خوشحالیم که براتون مفید بوده.
هر دالتون برابر 27-^10×1.660538921 کیلوگرم است.