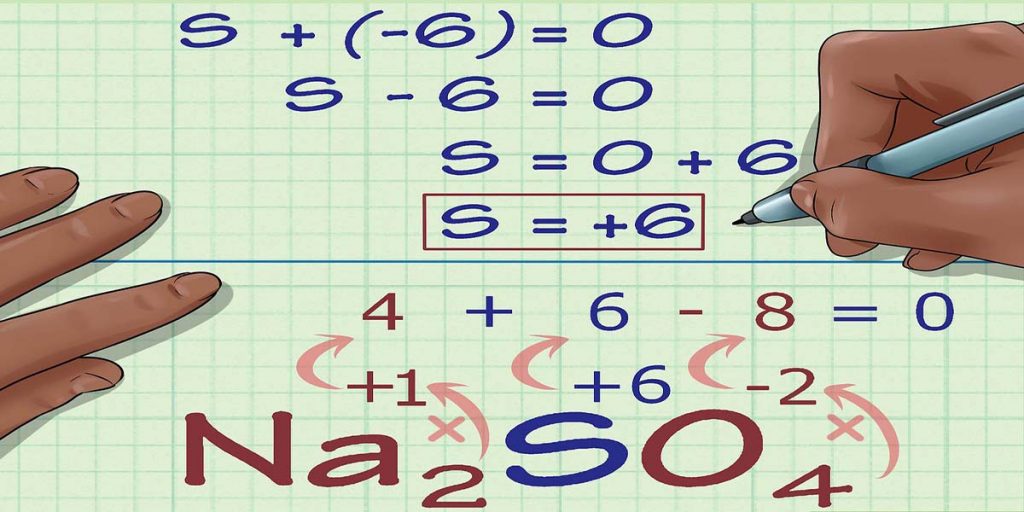عدد اکسایش چیست؟ چگونه اعداد اکسایش را محاسبه کنی؟ چگونه می توانیم از اعداد اکسایش برای شناسایی واکنش های اکسایش و کاهش استفاده کنیم؟در این مقاله درباره اعداد اکسیداسیون خواهیم آموخت.

واکنش های الکتروشیمیایی شامل انتقال الکترون ها هستند. در واکنش های اکسایش و کاهش، جرم و بار هنگام موازنه ثابت میمانند ولی لازم است بدانید که در یک واکنش الکتروشیمیایی کدام اتم ها اکسید و کدام اتم ها کاهش می یابند. برای نشان دادن تعداد الکترون های از دست رفته یا بدست آمده توسط هر اتم از اعداد اکسایش استفاده می شود. با استفاده از قوانین زیر اعداد اکسیداسیون اتمها محاسبه میشود.
قوانین تعیین اعداد اکسایش
- به صورت قراردادی در فرمول شیمیایی ابتدا کاتیون و سپس آنیون نوشته می شود. به عنوان مثال، هیدروژن در NaH به صورت –H و در HCl به صورت +H است.
- عدد اکسایش یک عنصر آزاد همیشه برابر صفر است. به عنوان مثال ، اتمهای موجود در He و N2 دارای تعداد اکسیداسیون صفر هستند.
- عدد اکسایش یک یون تک اتمی برابر با بار یون است. به عنوان مثال ، عدد اکسیداسیون+Na برابر 1+ و عدد اکسیداسیون -3 N برابر 3- است.
- عدد اکسایش هیدروژن معمولا برابر 1+ است ولی در ترکیباتی که حاوی عناصر دارای الکترونگاتیوی کمتر نسبت به هیدروژن هستند عدد اکسایش هیدروژن برابر 1- است. به عنوان مثال در ترکیب CaH2 هیدروژن دارای عدد اکسایش 1- است.
- عدد اکسایش اکسیژن در ترکیبات معمولاً -2 است. موارد استثنا شامل OF2 (به دلیل الکترونگاتیوی بیشتر F نسبت به O ) و BaO2 (به دلیل ساختار یون پراکسید 2-[O-O]) است.
- عدد اکسایش یک عنصر گروه IA در ترکیبات برابر 1+ است.
- عدد اکسایش یک عنصر گروه IIA در ترکیبات برابر 2+ است.
- عدد اکسایش یک عنصر گروه VIIA در یک ترکیب 1- است ، مگر در مواردی که آن عنصر با عنصر دارای الکترونگاتیوی بیشتر ترکیب شود. عدد اکسایش Cl در HCl برابر 1- و در ترکیب HOCl برابر +1 است.
- مجموع اعداد اکسایش اتمهای یک ترکیب خنثی برابر صفر است.
- مجموع اعداد اکسایش در یون چند اتمی برابر با بار یون است. به عنوان مثال ، مجموع اعداد اکسیداسیون برای -SO42برابر 2- است.