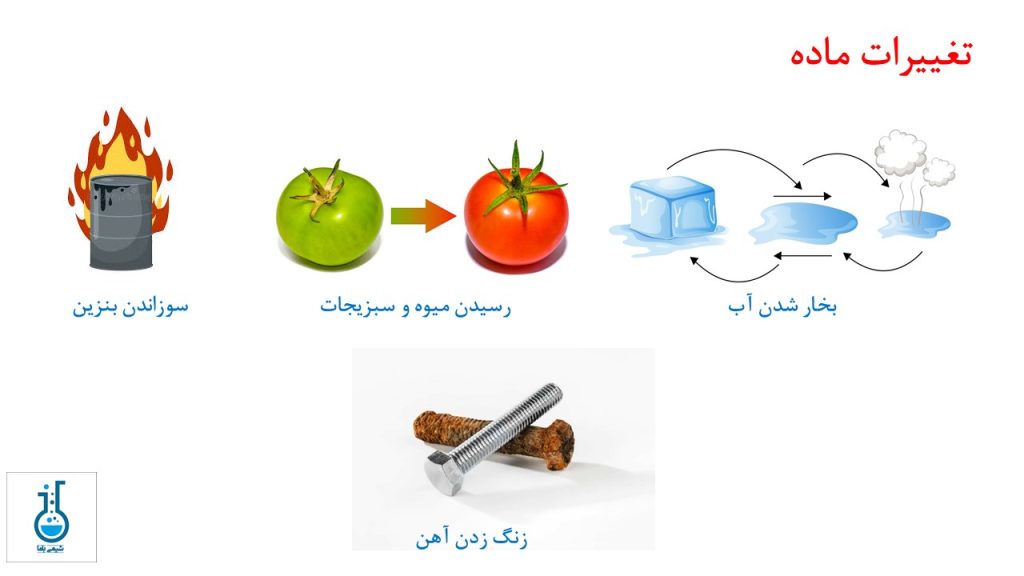
ما هر روز شاهد تعداد بسیار زیادی از انواع تغییرات در ماده هستیم، به عنوان مثال آهن زنگ میزند، بنزین را میسوزانیم، میوهها و سبزیجات میرسند و آب بخار میشود. آیا تا به حال فکر کردهاید که در طی این تغییرات چه اتفاقی برای مولکولها یا اتمهای تشکیل دهنده مواد میافتد؟ پاسخ این سوال به نوع تغییر بستگی دارد. به طور کلی تغییر در مواد به دو دسته تغییر فیزیکی و تغییر شیمیایی طبقهبندی میشود. اگر علاقهمند هستید که با مفهوم تغییر فیزیکی و تغییر شیمیایی آشنا شوید در ادامه با ما همراه شوید.
تغییر فیزیکی
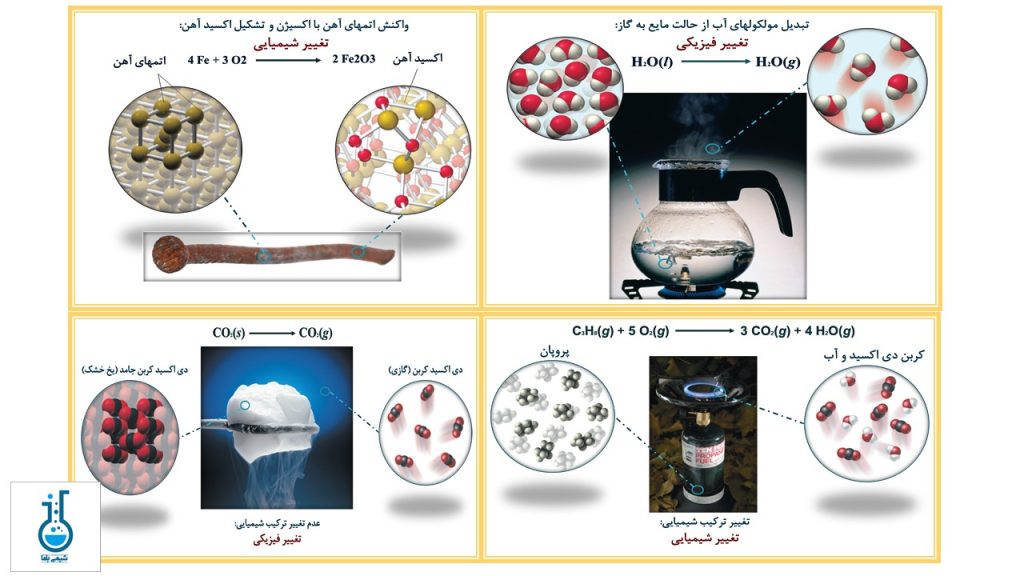
تغییر فیزیکی، تغییراتی هستند که تنها وضعیت و ظاهر ماده را تغییر میدهند ولی تغییری در ترکیب ماده ایجاد نمیکنند. در طول یک تغییر فیزیکی، اتمها یا مولکولهای تشکیل دهنده یک ماده، هویت خود را تغییر نمیدهند. به عنوان مثال، هنگامی که آب جوش میآید، حالت ماده از مایع به گاز تغییر میدهد، اما گاز همچنان از مولکولهای آب تشکیل شده است، بنابراین جوشیدن آب یک تغییر فیزیکی است.

تغییر شیمیایی
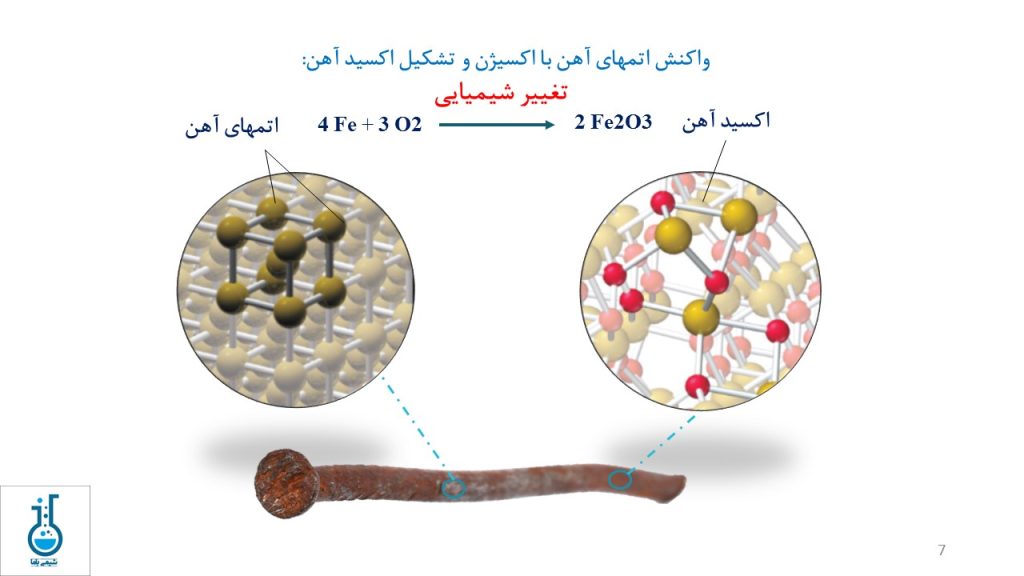
به تغییراتی که ترکیب ماده را تغییر میدهند، تغییر شیمیایی گفته میشود. در تغییر شیمیایی، اتمها بازآرایی شده و مواد اولیه به مواد مختلفی تبدیل میشوند. به عنوان مثال، زنگ زدگی آهن یک تغییر شیمیایی است که در آن اتمهای فلز آهن با مولکولهای اکسیژن هوا ترکیب میشوند تا اکسید آهن را تشکیل دهند. اکسید آهن یک ماده نارنجی رنگ است که ما آن را به عنوان زنگ آهن میشناسیم.
مقایسه تغییر فیزیکی و تغییرشیمیایی
تفاوتهای بین تغییرات فیزیکی و تغییرات شیمیایی همیشه واضح نیست و تنها بررسی شیمیایی میتواند تایید کند که یک تغییر فیزیکی یا شیمیایی است. با این حال، در بسیاری از موارد، ما میتوانیم تغییرات شیمیایی و فیزیکی را بر اساس آنچه که درباره تغییرات میدانیم، شناسایی کنیم. به عنوان مثال تغییراتی که در حالت ماده رخ میدهد، مانند ذوب یا جوش، یا تغییرات ایجاد شده در شکل ماده، مانند تغییرات ناشی از برش یا خرد شدن ، به طور معمول تغییرات فیزیکی هستند و تغییراتی که همراه با واکنشهای شیمیایی بوده و اغلب با تغییرات دما یا رنگ همراه هستند، تغییرات شیمیایی محسوب میشوند.
مثالهایی از تغییر فیزیکی و شیمیایی
به دی اکسید کربن جامد، یخ خشک گفته میشود. فرآیند تصعید یخ خشک یک تغییر فیزیکی است که در آن دی اکسید کربن جامد به دی اکسید کرن گازی تبدیل میشود. از آنجایی که ترکیب شیمیایی دی اکسید کربن در این فرآیند تغییر نمیکند، میتوان گفت که تصعید یخ خشک یک تغییر فیزیکی است.

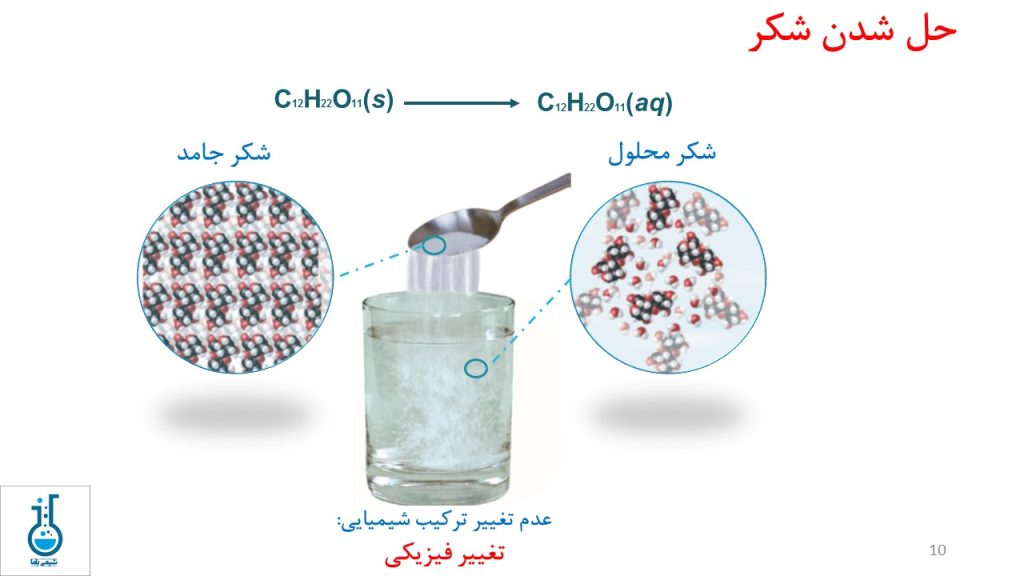
حل شدن شکر در آب نیز یک تغییر فیزیکی است که در آن شکر جامد به شکر محلول تبدیل میشود و تغییری در ترکیب شیمیایی آن رخ نمیدهد.
در فرآیند سوختن گاز پروپان، مولکولهای گازی پروپان با اکسیژن هوا ترکیب شده و منجر به تولید کربن دی اکسید و آب میشوند. بنابراین ترکیب شیمیایی مواد اولیه در این فرآیند تغییر میکند و میتوان گفت که سوختن گاز پروپان یک تغییر شیمیایی است.
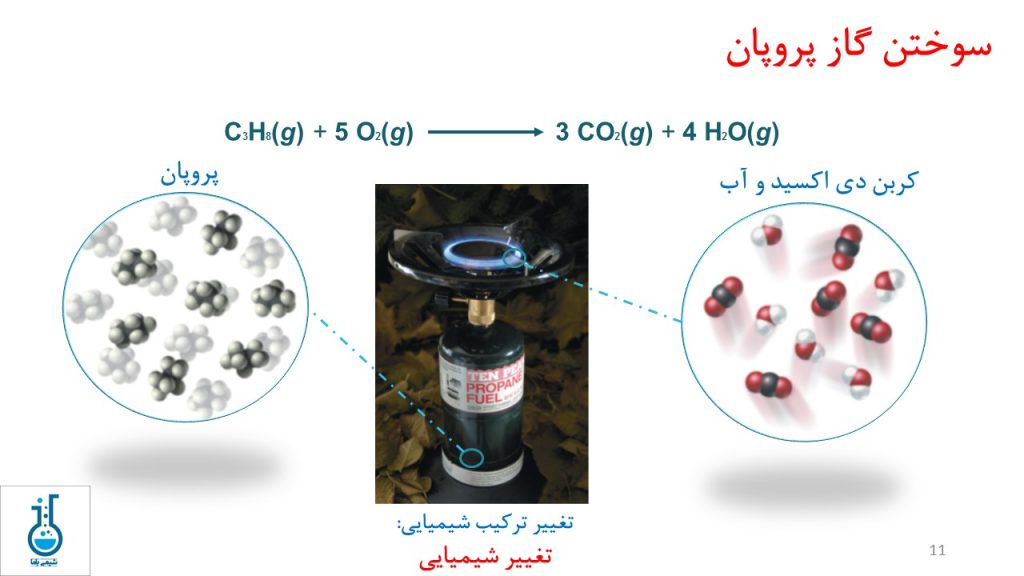
تغییرات فیزیکی و شیمیایی نمایانگر ویژگیهای فیزیکی و شیمیایی هستند.
خواص فیزیکی
هر ویژگی فیزیکی که میتوانید ببینید، بو کنید، لمس کنید و بشنوید یا به عبارت دیگر تشخیص دهید و بدون انجام واکنش شیمیایی، اندازهگیری کنید ، یک ویژگی فیزیکی است. خواص فیزیکی مواد خود به دو دسته جزئی تقسیم می شوند:
- خواص فیزیکی متمرکز (Intensive Properties)
- خواص فیزیکی گسترده (Extensive Properties)
خواص فیزیکی متمرکز (Intensive Properties)
خواص فیزیکی متمرکز، مستقل از حجم یا اندازه ماده بوده و به مقدار ماده وابسته نیستند. برخی از مثالهای ویژگیهای متمرکز عبارتند از:
- فشار: نیرویی اعمال شده بر واحد سطح
- دما: میزان گرما یا سرمای نسبی
- غلظت: مقدار ماده در یک مخلوط.
- نقطه ذوب: دمایی که جامد به مایع تبدیل میشود.
- نقطه جوش: دمایی که در آن یک مایع به گاز تبدیل میشود.
- چگالی: وزن در هر واحد حجم
- رنگ
- بو
- طعم
- انعطافپذیری
- قابلیت تغییر شکل
- حلالیت
- هدایت الکتریکی
خواص فیزیکی گسترده (Extensive Properties):
خواص فیزیکی گسترده به مقدار ماده موجود در ماده وابسته هستند و مقدار ماده تعیین کننده آن خواص است. در زیر مثالهایی از خواص فیزیکی گسترده آورده شده است.
- جرم
- وزن
- طول
- عرض
- مساحت
- ارتفاع
- حجم

خواص شیمیایی
خواص شیمیایی ماده ویژگیهایی هستند که یک ماده فقط با تغییر ترکیب خود از طریق یک تغییر و یا واکنش شیمیایی بروز میدهد. برخلاف خواص فیزیکی، خواص شیمیایی از طریق مشاهده یا لمس قابل اندازه گیری نیستند. با مطالعه خواص شیمیایی، ترکیبات طبقهبندی میشوند و رفتار، واکنشها و کاربردهای آنها مورد بررسی قرار میگیرند. همچنین با شناخت خواص شیمیایی مواد شیمیایی، می توان آنها را جداسازی و یا تصفیه کرد.
انواع خواص شیمیایی
- واکنشپذیری: به توانایی یک ماده برای واکنش با مواد دیگر گفته میشود. این ویژگی تعیین میکند که چقدر احتمال دارد ماده وارد واکنش شیمیایی شود و با چه سرعتی این واکنش انجام خواهد داشت. برخی از عناصر نسبت به دیگران واکنشپذیرتر هستند که میتوان این ویژگی را از سری واکنشپذیری مطالعه کرد.
- قابلیت اشتعال
- درجه اکسایش :اندازهگیری میزان از دست دادن الکترونها یا اکسایش. درجه اکسایش تنها زمانی مشخص میشود که یک عنصر در یک واکنش شیمیایی شرکت کند.
- پایداری شیمیایی: به توانایی یک ماده برای رسیدن به تعادل شیمیایی با محیط خود پس از یک واکنش گفته میشود.
- گرمای احتراق
- انتالپی تشکیل
- الکترونگاتیویته
- حلالیت
- سمیت
- قدرت اسیدی
- قدرت بازی
چرا تغییر فیزیکی و تغییر شیمیایی رخ میدهد؟
تغییرات فیزیکی و شیمیایی، معمولاً همراه با تغییرات انرژی همراه هستند. به عنوان مثال، هنگامی که آب از پوست شما تبخیر میشود (یک تغییر فیزیکی)، مولکولهای آب از بدن شما انرژی جذب کرده و شما احساس خنکی میکنید. هنگامی که گاز را در روی اجاق میسوزانید (یک تغییر شیمیایی)، انرژی آزاد شده و غذا را گرم میکند. درک تغییرات فیزیکی و شیمیایی ماده، یا به عبارتی، درک شیمی، نیازمند درک تغییرات انرژی و جریان انرژی است.
تعریف علمی انرژی، ظرفیت انجام کار است. وقتی کار انجام میشود که نیرو وارد شده بر جسم سبب جابجایی جسم شود. به عنوان مثال، وقتی یک جعبه را روی زمین میکشید یا دوچرخهی خود را از خیابان عبور میدهید، شما در حال انجام کار هستید.

تغییرات انرژی در جریان تغییر فیزیکی و تغییر شیمیایی
انرژی کل یک جسم مجموع انرژی جنبشی (انرژی مرتبط با حرکت) و انرژی پتانسیل (انرژی مرتبط با موقعیت یا ترکیب) است. به عنوان مثال، اگر یک جسم چند متر بالاتر از زمین نگه داشته شود، به دلیل موقعیتش در میدان گرانشی زمین دارای انرژی پتانسیل است.

اگر جسم را رها کنید، سرعت گرفته و انرژی پتانسیلی آن به انرژی حرکتی تبدیل میشود. وقتی جسم به زمین میخورد، انرژی حرکتی آن به انرژی حرارتی تبدیل میشود که انرژی مرتبط با دمای یک جسم است. البته انرژی حرارتی در واقع یک نوع انرژی حرکتی است که مرتبط با حرکت اتمها یا مولکولهای تشکیل دهنده جسم است. وقتی جسم به زمین برخورد میکند، انرژی حرکتی آن به اتمها و مولکولهای تشکیل دهنده زمین منتقل شده و دمای زمین را کمی افزایش میدهد.
- اولین اصلی که باید در مورد تغییر انرژی هنگام سقوط جسم بایستی به آن توجه کنید، این است که انرژی نه ایجاد میشود و نه از بین میرود و اتفاقی که میافتد این است که انرژی پتانسیل جسم به انرژی جنبشی تبدیل میشود و زمانی که جسم به سمت زمین شتاب میگیرد. انرژی جنبشی به انرژی حرارتی تبدیل میشود و وقتی که جسم به زمین برخورد میکند. مقدار کل انرژی حرارتی که از طریق این فرآیند آزاد میشود دقیقاً برابر با انرژی پتانسیل اولیه جسم است. این فرضیه که انرژی نه ایجاد میشود و نه از بین میرود به عنوان قانون پایستاری انرژی شناخته میشود.
- اصل دومی که باید در مورد جسم واقع بر روی لبه دیوار و سقوط آن توجه کنیم، تمایل سیستمهای دارای انرژی پتانسیل بالا به تغییر جهت کاهش انرژی ذخیره شده است. به همین دلیل، اجسام یا سیستمهایی با انرژی پتانسیل بالا ناپایدار هستند. جسمی که چند متر بالاتر از زمین و بر لبه دیوار قرار گرفته است، به دلیل اینکه حاوی مقدار قابل توجهی انرژی پتانسیل است، پایدار نیست و جسم به منظور کاهش انرژی پتانسیل خود، به طور طبیعی سقوط خواهد کرد (به دلیل موقعیتش در میدان گرانشی زمین).
ما میتوانیم بخشی از انرژی پتانسیل این جسم را برای انجام کار مورد استفاده قرار دهیم. به عنوان مثال، میتوانیم جسم را به یک طناب متصل کنیم تا هنگام سقوط یک چرخ پره یا دستگاه حفاری را بچرخاند.
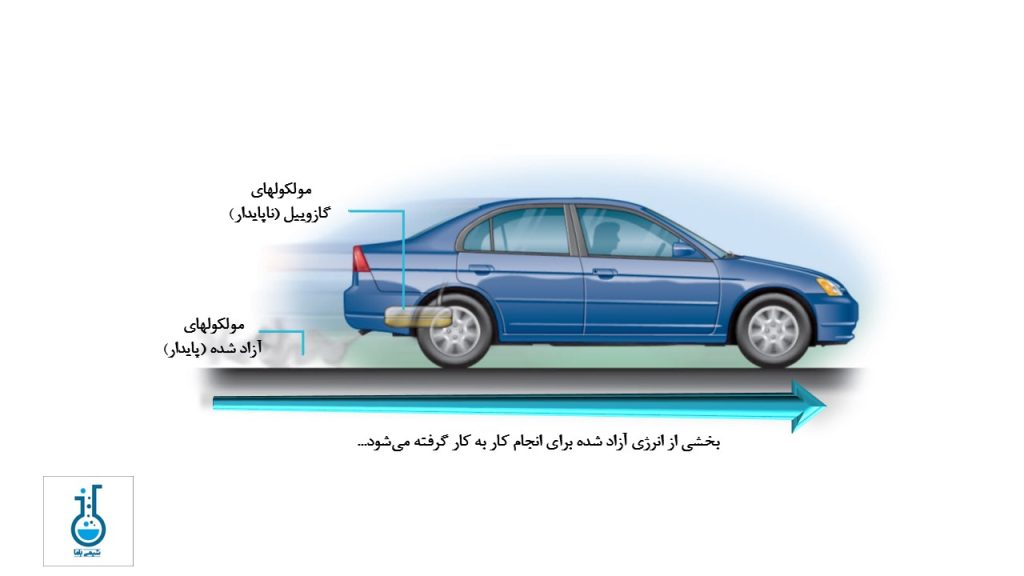
برخی از مواد شیمیایی مانند جسم واقع در لبه دیوار هستند. به عنوان مثال، مولکولهای تشکیل دهنده بنزین، انرژی پتانسیل نسبتاً بالایی دارند و انرژی در آنها ذخیره شده است. انرژی پتانسیل شیمیایی این مولکولها از نیروهای الکترواستاتیکی بین ذرات الکتریکی باردار (پروتونها و الکترونها) که اتمها و مولکولها را تشکیل میدهند، ناشی میشود. این مولکولها تمایل دارند تا تغییرات شیمیایی (به ویژه احتراق) را تجربه کنند تا انرژی پتانسیل آنها کاهش یابد و پایدارتر شوند.
هنگامی که بنزین میسوزد، ترکیب شیمیایی آن تغییر میکند و مولکولهایی با انرژی پتانسیل کمتر ایجاد میشوند. در حین این تغییر مقدار زیادی انرژی (بیشتر به صورت گرما) به محیط انتقال مییابد که بخشی از آن میتواند برای انجام کار مانند حرکت خودرو مورد استفاده قرار گیرد.
نتیجه گیری
تغییر فیزیکی، تنها وضعیت و ظاهر ماده را تغییر میدهد و تغییری در ترکیب ماده و اتمها یا مولکولهای تشکیل دهنده یک ماده ایجاد نمیکند. ولی در تغییر شیمیایی، اتمهای اولیه بازآرایی شده و به مواد مختلفی تبدیل میشوند. در نظر داشته باشید که انرژی همیشه در یک تغییر فیزیکی یا شیمیایی ثابت میماند و سیستمهایی که دارای انرژی پتانسیل بالایی هستند، به شکلی تغییر میکنند که انرژی پتانسیل آنها کاهش یافته و انرژی آزاد شده به محیط اطراف منتقل گردد.