ساختار مولکولی آرایش سه بعدی اتم ها در یک مولکول است و هندسه و موقعیت نسبی هسته اتمی یک مولکول را توصیف می کند. تئوری VSEPR «دافعه زوج الکترون لایه ظرفیت» یکی از ساده ترین مدلها برای درک هندسه مولکولی است. در این مقاله با ما همراه باشید تا ساختار مولکولهای آلی را با استفاده از نظریه VSEPR بررسی کنیم.

بسیاری از خواص یک ماده مانند واکنشپذیری، رنگ ، فعالیت بیولوژیکی ، حالت ماده ، قطبیت و سایر خصوصیات مولکول توسط هندسه و ساختار مولکول تعیین می شود. بسیار مهم است که بتوانیم ساختار مولکولی یک مولکول را پیش بینی و درک کنیم. با استفاده از ساختار های لوئیس میتوانیم تعداد و نوع پیوندهای تشکیل شده بین اتمهای یک ماده تعیین کنیم ولی ساختار لوویس هیچ اطلاعاتی در مورد آرایش واقعی اتم ها در فضا نمی دهد. برای پیش بینی شکل مولکولی بایستی از نظریه «دافعه زوج الکترون لایه ظرفیت» (VSEPR) (تلفظ “vesper”) استفاده کنیم. برای درک نظریه وسپر کافی است بخاطر داشته باشید که اتمها بخاطر دافعه بین الکترونهای موجود تمایل دارند تا آنجا که ممکن است از یکدیگر فاصله داشته باشند.
مدل VSEPR چگونه ساختار مولکولها را پیش بینی میکند؟
هندسه مولکولی با توجه به زوایای پیوند تشکیل شده بین دو پیوند مجاور توصیف میشود. یک مولکول را فرض کنید که دارای یک اتم مرکزی و چندین اتم متصل به آن است (کره قرمز نشان دهنده اتم مرکزی و کره آبی اتم متصل به آن است). برای پیش بینی ساختار هندسی این مولکول بایستی به خاطر داشته باشیم که اتمهای آبی یکدیگر را دفع می کنند و ترجیح میدهند که تا حد امکان از هم دور باشند.

بیاید برای نشان دادن چگونگی عملکرد مدل VSEPR از چند مثال ساده استفاده کنیم:
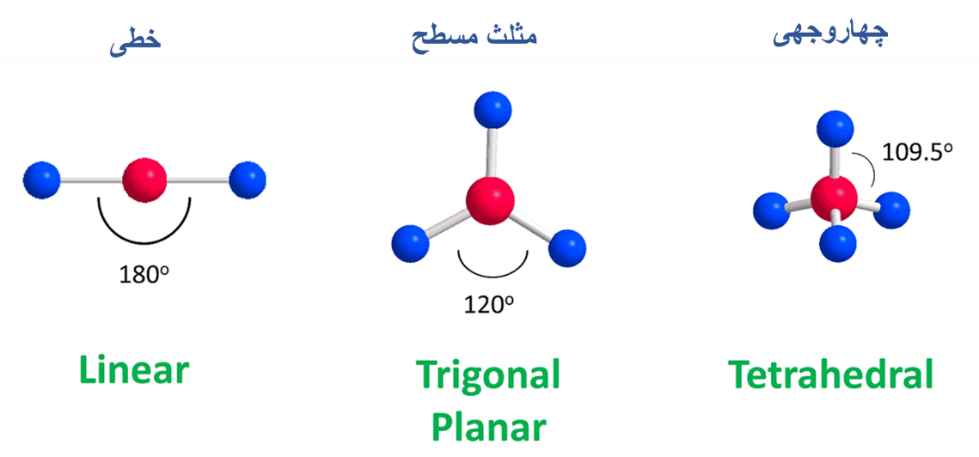
- فرض کنید مولکولی یک اتم مرکزی و دو اتم متصل به آن داشته باشد. در این حالت قرار دادن اتمها در زاویه 180 درجه از یکدیگر ساختار بهینه را فراهم می کند:
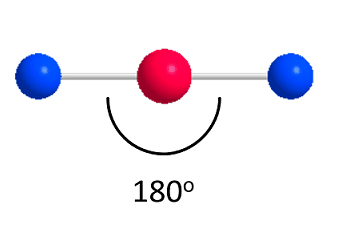
- هنگامی که سه اتم در اطراف واحد مرکزی وجود داشته باشد، زاویه مطلوب 120 درجه است:
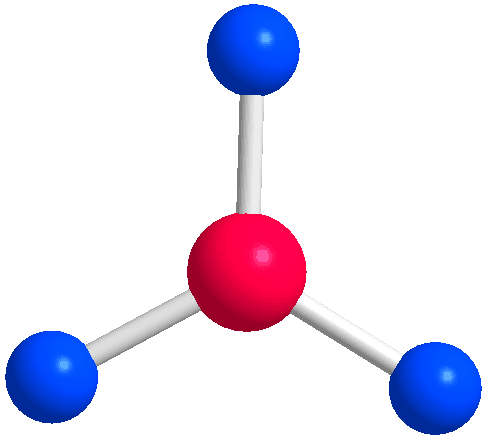
- به نظر شما وقتی چهار اتم به مرکز متصل باشند ساختار مولکول چگونه خواهد بود؟

اگر شما در مورد ساختار چهار وجهی چیزی نشنیده باشید اولین ساختاری که به ذهنتان میرسد ساختار 90 درجه است، ولی در ساختار چهار وجهی (Tetrahedral) اتمها فاصله بیشتری از همدیگر دارند و زاویه بین گروهها 109.5 است. بنابراین ساختار چهاروجهی، ساختار بهینه برای چهار گروه متصل به اتم مرکزی محسوب میشود.
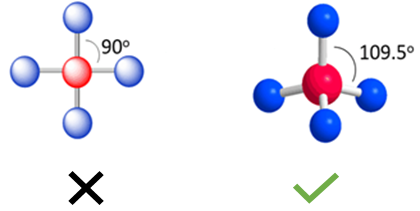
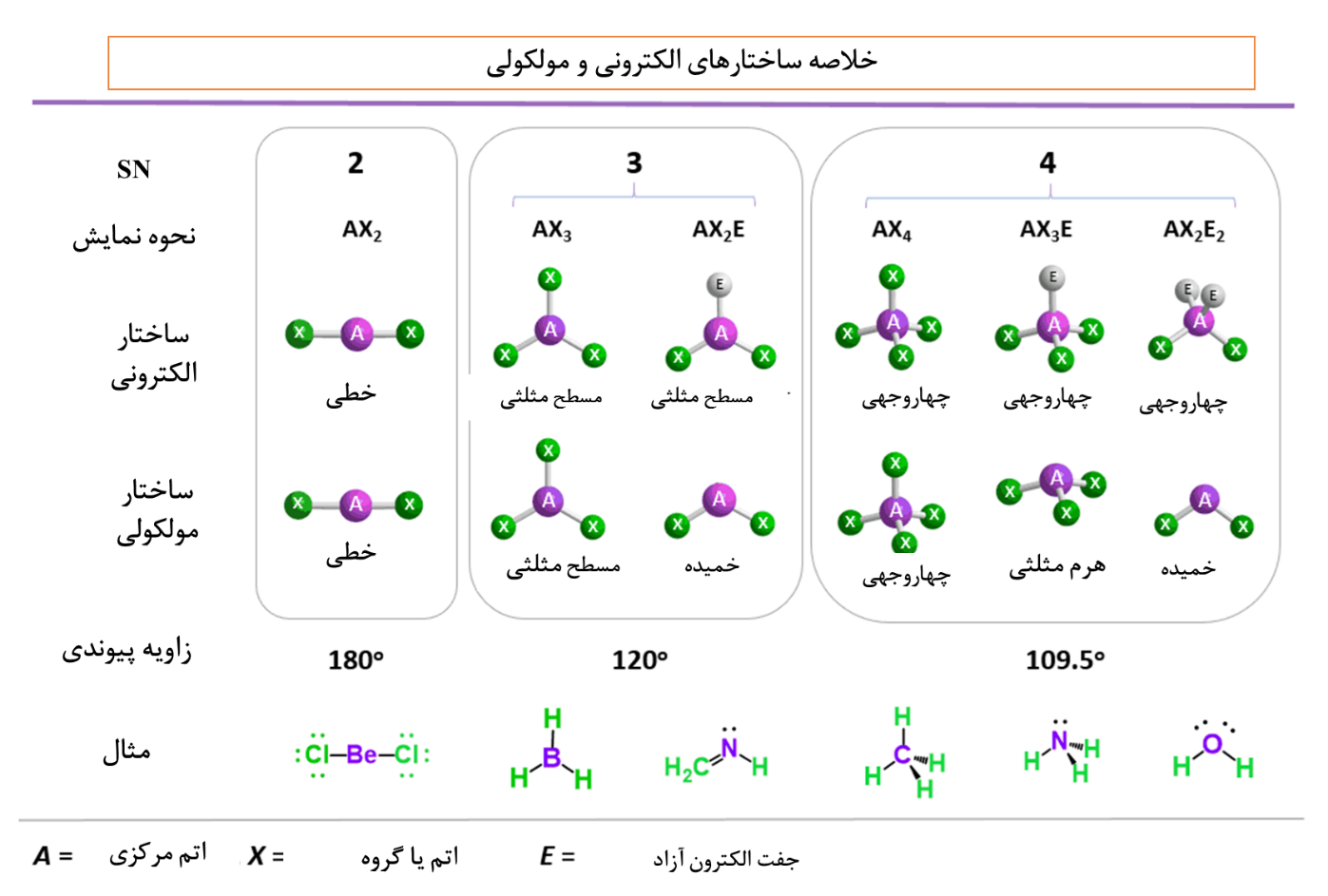
- هریک از ساختار های مولکولی دارای اسم مشخص هستند. به عنوان مثال اسامی ساختارهای مورد بررسی را مشاهده میکنید:
در ترکیبات مختلف اتم مرکزی میتواند به بیش از چهار اتم متصل شود ولی در ساختارهای آلی اتم کربن حداکثر میتواند به چهار اتم دیگر اتصال داشته باشد.
عدد استریک (Steric number) یا قلمرو الکترونی چیست؟
- در مطالب قبلی گفتیم که کره های آبی نشانگر اتم ها هستند. ولی در مولکول های واقعی، کرههای آبی نماینده وجود اتم ها و جفت الکترونهای آزاد هستند و قلمرو الکترونی نامیده میشوند. در شیمی به مجموع تعداد اتمهای متصل به اتم مرکزی و جفت الکترونهای آزاد (lone pairs)، عدد استریک (SN=Steric number) گفته می شود. برای اینکه قلمرو الکترونی را تعیین و ساختارهای مولکولی را پیش بینی کنید بایستی حتما با ساختارهای لوویس آشنا باشید.

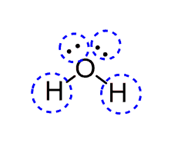
- در مولکول آب چهار قلمرو الکترونی وجود دارد. اتم مرکزی اکسیژن دارای دو جفت الکترون آزاد و دو اتم هیدروژن متصل به آن است.
- در شکل زیر برخی از ساختارهای مولکولی و عدد استریک آنها را مشاهده میکنید:
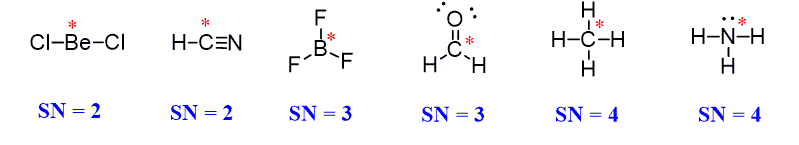
توجه داشته باشید که در مولکولهای (CH4 و NH3) عدد استریک یکسان است ولی تعداد اتمها و جفتهای الکترونهای آزاد آنها متفاوت است. برای تفکیک ساختار ترکیباتی که عدد استریک یکسان و تعداد اتمها و جفت الکترونهای تنهای متفاوت دارند لازم است که با ساختارهای الکترونی و مولکولی آشنا شوید.
با ساختارهای الکترونی و مولکولی آشنا شوید
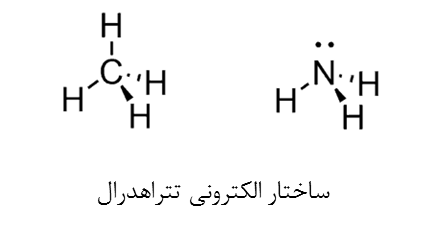
- در ساختار الکترونی، اتم های متصل به اتم مرکزی و الکترون های آزاد به صورت واحدهای یکسان در نظر گرفته میشوند. بنابراین دو مولکول CH4 و NH3 عدد استریک برابر دارند (SN=4)و ساختار الکترونی هردو چهاروجهی است.
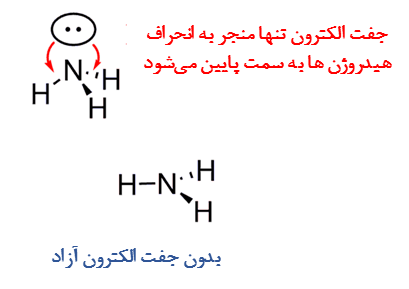
- در ساختار مولکولی، اتم های متصل شده به اتم مرکزی و الکترون های آزاد را به صورت واحدهای جداگانه هستند. به عنوان مثال تعداد اتم های متصل به اتم مرکزی و جفت آزاد در مولکول های CH4 و NH3 متفاوت است و با وجود اینکه ساختار الکترونی یکسان دارند ولی ساختار مولکولی آنها متفاوت است. ساختار مولکولی متان (CH4) به صورت چهار وجهی و ساختار مولکولی آمونیاک (NH3) هرمی مثلثی است. در تعیین ساختار مولکولی آمونیاک، جفت الکترون آزاد نیتروژن نقش مهمی دارد و اگر وجود نداشت، یک مولکول فرضی با هندسه مثلثی مسطح داشتیم.
چگونه ساختار الکترونی و مولکولی را مشخص کنیم؟
شما به راحتی میتوانید ساختارهای الکترونی و مولکولی ترکیبات آلی را پیش بینی کنید. برای پیش بینی هندسه الکترونی و مولکولی مراحل زیر را به ترتیب انجام دهید:
- ساختار لوییس را برای مولکول ترسیم کنید.
- تعداد اتم ها و جفت های منفرد الکترون روی اتم مرکزی را بشمارید (عدد استریک).
- اتمها را به گونه ای مرتب کنید که دافعه به حداقل برسد (تا آنجا که ممکن است اتمها از یکدیگر فاصله داشته باشند).
- نام ساختار الکترونی و مولکولی را با توجه به جدول زیر تعیین کنید.
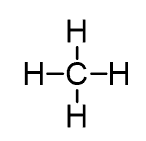
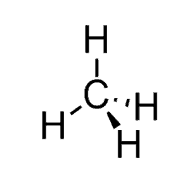
چگونه ساختار ترکیبات BeCl2 ، BH3 ، CH2NH و CH4 را پیش بینی کنیم؟
برای پیش بینی ساختار ترکیبات مختلف کافی است مراحل ذکر شده در بالا را برای هرکدام از مولکولها به صورت مرحله به مرحله انجام دهید:
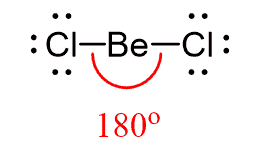
پیش بینی ساختار BeCl2
- ابتدا ساختار لوئیس ترکیب را رسم کنید:
- عدد استریک را به دست آورید و با توجه به جدول، نوع ساختار را مشخص کنید: دو اتم کلر به اتم مرکزی متصل شده و اتم مرکزی فاقد جفت الکترون تنها است بنابراین عدد استریک برابر SN=2 و ساختار از نوع AX2 است. (S.N. (Be) =2atoms +0 lone pairs=2)
- برای به حداقل رساندن دافعه، اتمهای کلر را در زوایه 180 درجه نسبت به هم قرار دهید:

- نام ساختار الکترونی و مولکولی را تعیین کنید: ساختار الکترونی و مولکولی BeCl2 به صورت خطی است
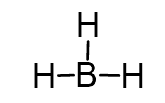
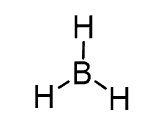
پیش بینی ساختار BH3
- ساختار لوئیس :

- سه اتم هیدروژن به اتم مرکزی بور متصل و اتم مرکزی فاقد جفت الکترون آزاد است. بنابراین عدد استریک بور برایر 3 (S.N. (B) = 3 atoms + 0 lone pairs = 3) و از گروه AX3 است.
- هیدروژنها باید در زاویه 120 درجه قرار داشته باشند تا دافعه به حداقل برسد.

- همه اتم ها در یک صفحه هستند و اتم مرکزی فاقد جفت الکترون تنها است. ساختار ساختار الکترونی و مولکولی به صورت مسطح مثلثی است.
پیش بینی ساختار CH2NH
- ساختار لوئیس:

- S.N (N) = 2 atoms + 1 lone pair = 3. دو اتم به اتم مرکزی متصل بوده و اتم مرکزی دارای یک جفت الکترون تنها است. بنابراین ترکیب در گروه AX2E قرار می گیرد.
- اتمها و الکترونهای تنها در زاویه حدود 120 درجه اطراف اتم نیتروژن قرار میگیرند

- ساختار مولکولی به صورت خمیده است. توجه داشته باشید که جفتهای الکترونهای آزاد دافعه بیشتری نسبت به اتمها دارند و منجر به انحراف زوایای پیوندی از مقادیر پیش بینی شده میشوند.
پیش بینی ساختار CH4
- ساختار لوئیس:

- S.N. (C) = 4 atoms + 0 lone pairs = 4 بوده و ساختار AX4 است.
- اتمها در زاویه 109.5از یکدیگر قرار دارند.

- ساختار الکترونی و مولکولی به صورت چهار وجهی است.
VSEPR و ساختار مولکولهای آلی
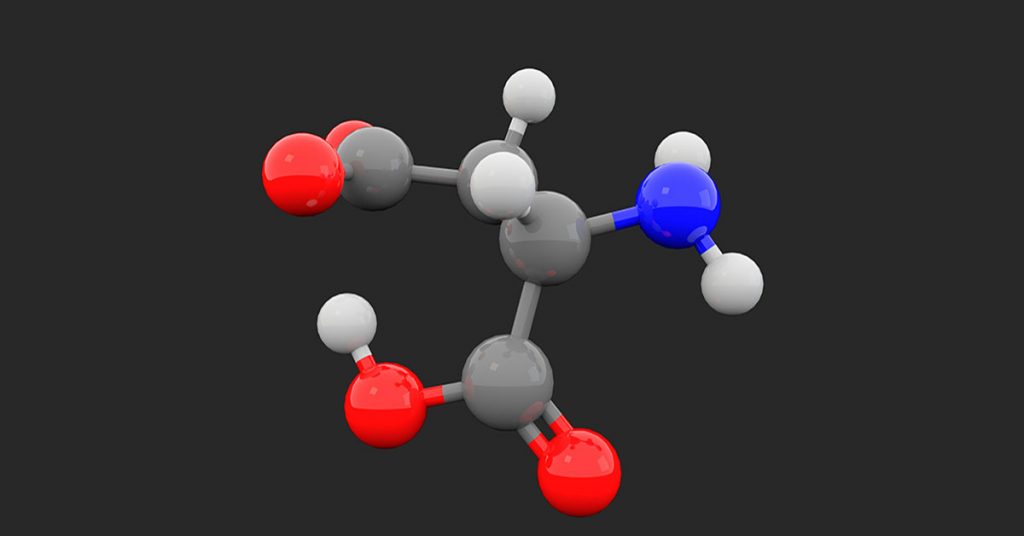
برای مولکول های کوچکتر ، ما یک اتم مرکزی داریم که براساس آن هندسه مولکولی را تعیین می کنیم. امادر مولکولهای آلی بزرگتر ، ممکن است به صورت دقیق نتوانیم ساختار مولکولی را پیش بینی کنیم . به عنوان مثال ، در این مولکول هیچ اتم مرکزی وجود ندارد:
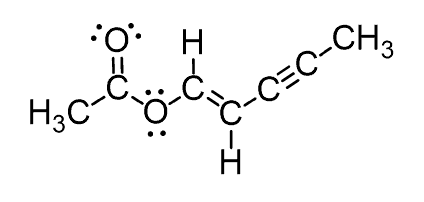
در این ترکیبات ساختار اتم ها به صورت جداگانه تعیین می شود. به عنوان مثال در ترکیب زیر اتم ها را شمارهگذاری کرده و ساختار آنها را بررسی میکنیم:
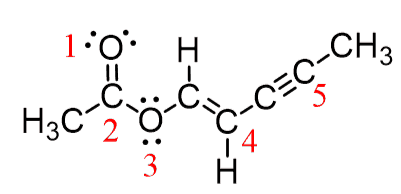
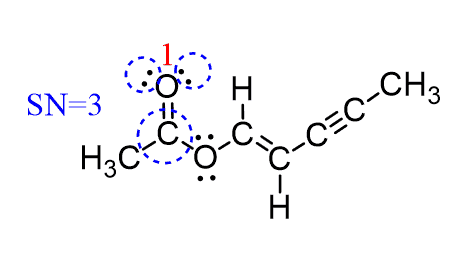
اکسیژن 1 به یک اتم متصل است و دارای دو جفت تنها است و عدد استریک SN = 3 است. هندسه الکترونی آن مسطح مثلثی و هندسه مولکولی آن خطی است:
کربن 2 دارای سه اتم است و فاقد جفت تنها است. عدداستریک SN = 3 است. هندسه الکترونی و مولکولی آن مسطح مثلثی است:
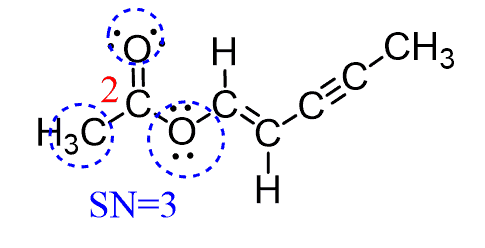
اکسیژن 3 به دو اتم متصل است و دو جفت تنها دارد و دقیقاً مانند آب SN = 4 است. بنابراین ، دارای هندسه الکترونی چهار وجهی و هندسه مولکولی خمیده است:
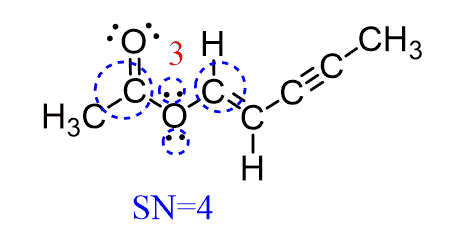
کربن 4 به سه اتم متصل است و هیچ جفت تنهائی ندارد. همچنین SN = 3 بوده و ساختار الکترونی و مولکولی به صورت مسطح مثلثی است:
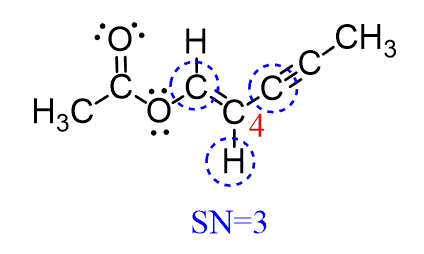
کربن 5 به دو اتم متصل است ، بدون جفت تنها است و دارای SN = 2 و ساختار الکترونی و مولکولی خطی است:
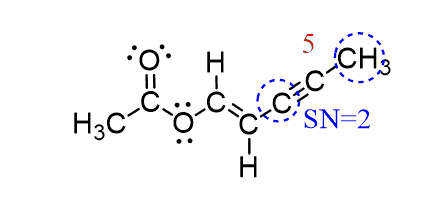
توجه کنید که در محاسبه عدد استریک (SN)، پیوندهای تکی، دوگانه و سهگانه یکسان در نظر گرفته میشوند.

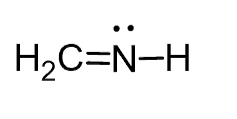
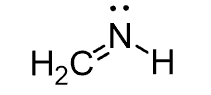

خیلی خوب بود ممنونمممممممممم
خواهش میکنم
عالی و بی نظیر
خفن ترین