منظور ما از تقارن در شیمی چیست؟ چگونه میتوانیم تقارن مولکولها را بدست آوریم؟. این مبحث جزو اولین مباحثی است در درس تخصص شیمی معدنی 1 دوره کارشناسی شیمی بررسی میشود. کاربرد تقارن مولکولی و نظریه گروه بسیار گسترده است و میتوان گفت برای ورود به دوره های تحصیلات تکمیلی آشنایی و تسلط به این مبحث الزامی است. اولین گام برای درک بهتر تقارن مولکولی آشنایی با مفاهیم اعمال تفارنی و عناصر تقارنی است. با ما همراه باشید تا با مفاهیم اولیه تقارن مولکولی آشنا شویم.

یکی از مهم ترین بخش های آموزش شیمی معدنی آموزش تقارن و بدست آوردن گروههای نقطهای است وقتی که میگوییم بعضی مولکولها متقارنتر از بقیه هستند برای همه ما واضح و شفاف هست و یا وقتی که از مولکولی با تقارن بالا و یا تقارن پایین صحبت میکنیم معلوم است که منظور ما چیست. اما برای اینکه بتوانیم تقارن را به بهترین نحو ممکن ارائه دهیم بایستی معیارهای ریاضی برای تقارن ارائه دهیم. عناصر و اعمال تقارنی با یکدیگر ارتباط تنگاتنگ دارند و به یکدیگر وابسته اند. ممکن است که مفاهیم آنها با یکدیگر درآمیخته شود در حالیکه این دو مفاهیم متفاوتی دارند و شما بایستی مفاهیم و تفاوتهای آنها را بدانید.
تعریف عمل تقارن
عمل تقارن، عملی است که اگر روی یک شی انجام شود آن را در وضعیتی قرار میدهد که غیرقابل تشخیص از ساختار اول و در واقع منطبیق بر آن باشد. به عنون مثال اگر چرخشهای 120 درجه را روی مولکول BF3 اعمال کنیم، در هر چرخش نمایشی از مولکول ایجاد میشود که از نمایش اول آن غیرقابل تشخیص است. هر کدام از این چرخشها مثالی از یک عمل تقارنی هستند.
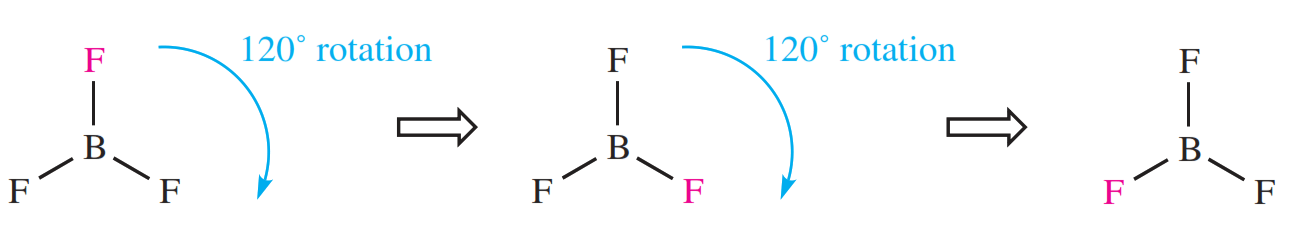
تعریف عنصر تقارن
یک عنصر تقارنی عنصری مثل خط، صفحه و یا یک نقطه است که عمل تقارنی نسبت به آن اجرا میشود. به عنوان مثال چرخشهای ·120 در مولکول BF3 حول محور عمود بر صفحه کاغذ انجام می شود و محور جرخشی از اتم بور رد میشود. در این مثال محور چرخشی یک عنصر تقارنی است.
ارتباط بین عنصر تقارنی و عمل تقارنی:
اعمال تقارنی از عناصر تقارنی حاصل میشوند. وجود یک عمل تقارنی به معنای وجود یک عنصر تقارنی متناظر است و برعکس، وجود یک عنصر تقاری به معنای انجام یک یا چند عمل تقارنی است. می توان گفت عنصر تقارن از نقاطی تشکیل شده است که هنگام انجام عمل تقارن در آن مکان ثابت باقی می مانند. در یک چرخش ، نقاطی که ثابت هستند یک محور تقارن را تشکیل می دهد. در انعکاس نقاطی که بدون تغییر باقی می مانند صفحه ای تقارن را تشکیل می دهند. در جدول زیر 5 نوع عمل تقارنی به همراه عناصر تقارنی متناظر آورده شده است.
علامت | عمل تقارن | عنصر تقارن |
E | یکسانی | – |
Cn | چرخش | محور محض |
σ | انعکاس نسبت به صفحه | صفحه |
i | مرکز وارونگی | مرکز تقارن |
Sn | چرخش به همراه انعکاس نست به صفحهای عمود بر محور | محور مرکب |
انواع عناصر تقارنی
محور چرخشی محض
این محور چرخشی محوری است که اگر مولکول را به اندازه درجه حول آن بچرخانیم شکل مولکول از شکل اولیه آن قابل تشخیص نباشد. محورچرخشی با نماد Cn نشان داده میشود و n مرتبه محور چرخشی نامیده میشود.. در هر مولکول محوری که بزرگترین مقدار n را دارد محور اصلی تقارن است. مقدار n را به راحتی میتوان با دانستن زوایای مولکولی حساب کرد.

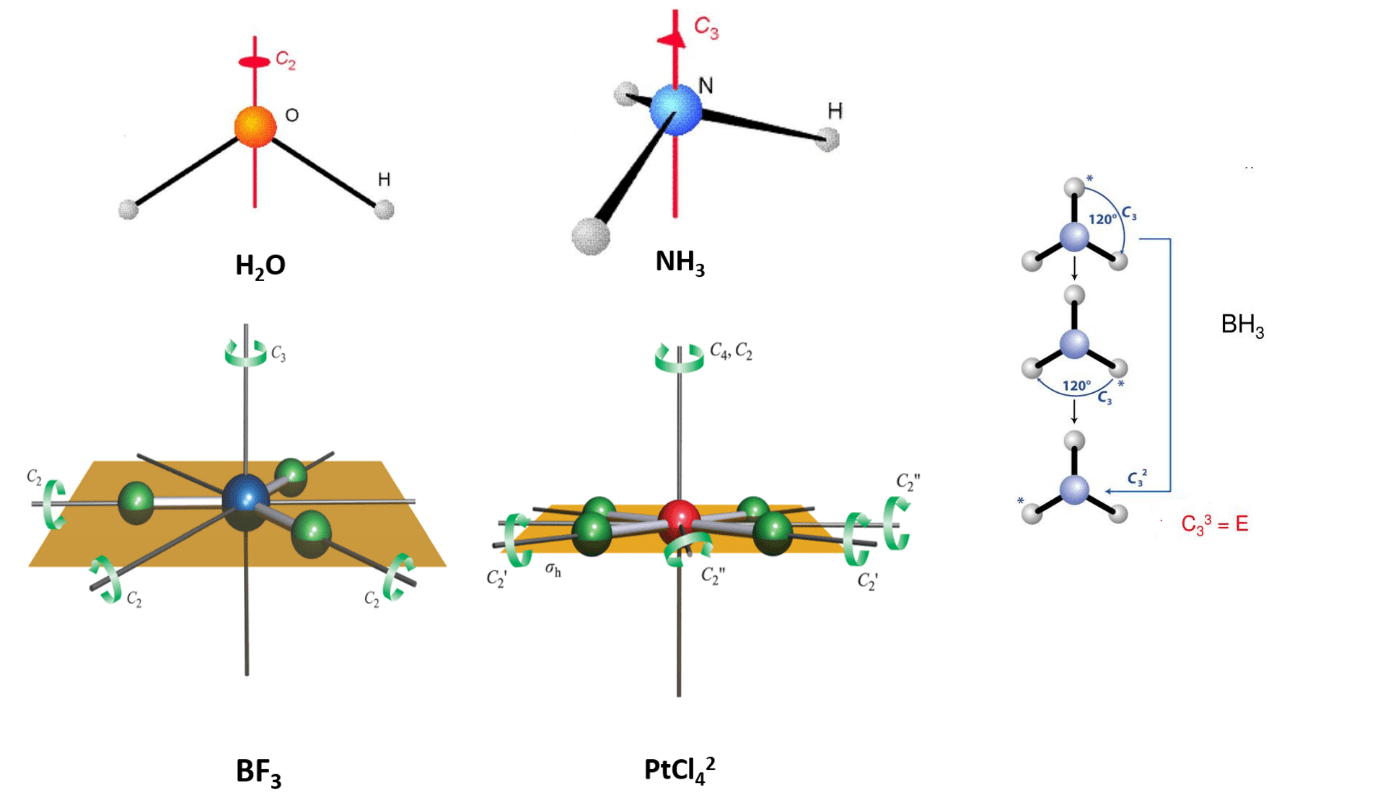
در شکل زیر مثالهایی از انواع محور های چرخشی آورده شده است:
- مولکول H2O یک محور چرخشی C2 دارد که در صفحه مولکول واقع است.
- مولکول NH3 یک محور چرخشی C3 دارد که از اتم N و مرکز وجه میگذرد.
- مولکول BF3 یک محور چرخشی C3 (عمود بر صفحه مولکول که از اتم بور میگذرد) و سه محور چرخشی C2 (عمود بر محور C3) است.
- مولکول PtCl42- یک محور چرخشی C4 (عمود بر صفحه مولکول که از اتم Pt میگذرد) و 4 محور چرخشی C2 (عمود بر محور C4) است.
- اگر مولکولی با محور Cn را به اندازه n بار بچرخانیم ( معادل چرخش 360 درجه ) مولکول به حالت اولیه خود باز میگردد و= E است. به عناون مثال اگر در مولکول CH3 محور C3 سه بار اعمال شود همانند آن است که عنصر یکسانی اعمال شده است.
صفحه تقارن
سطحی است که مولکول را دونیم میکند که هر نیمه آن تصویر آینهای نیمه دیگر است. صفحه تقارن با نماد یونانی σ مشخص میشود و عمل تقارنی که ایجاد میکند، عمل انعکاس است. صفحات تقارنی را به سه دسته زیر تقسیم میکنند:
- σv: صفحه ای است که محور اصلی را بر میگیرد و در واقع محور خطی در آن صفحه است. به عنوان مثال مولکولهای H2O و XeF4 دارای دو صفحه تقارن هستند که محور اصلی را در بر گرفتهاند.
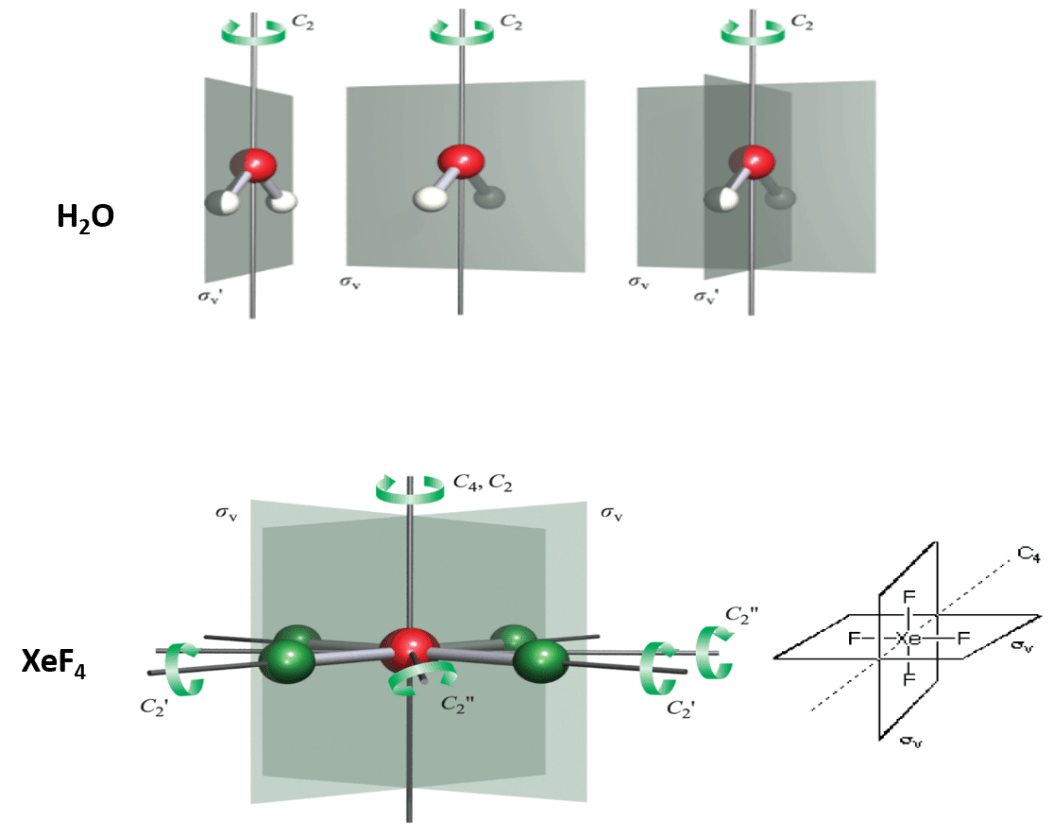
- σh : صفحه ای است که بر محور اصلی عمود است به عنوان مثال در مولکول XeF4 صفحه عمود بر محور اصلی C4 است.
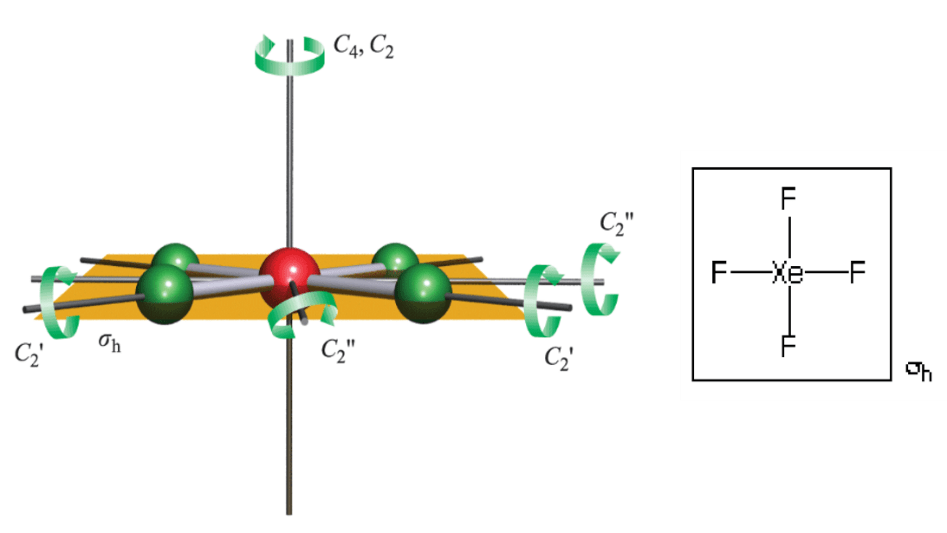
- σd : نوعی است که نیمساز دو محور C2 است و از تعداد اتمهای کمتری نسبت به عادی عبور میکند. به عنوان مثال در مولکول XeF4 صفحه محور C4 را دربرگرفته است و زاویه حاصل از دو محور C2 عمود بر Cn اصلی را نصف میکند.
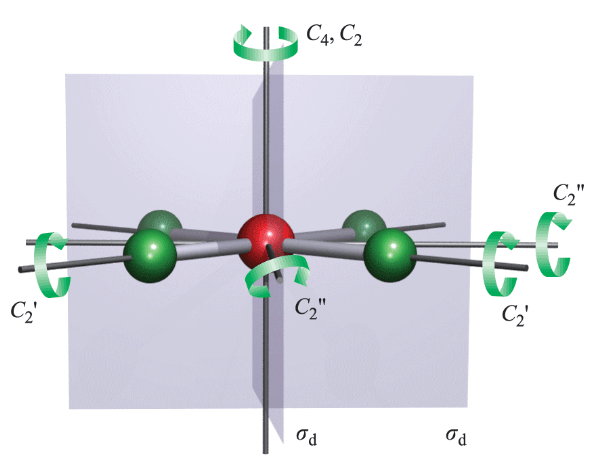
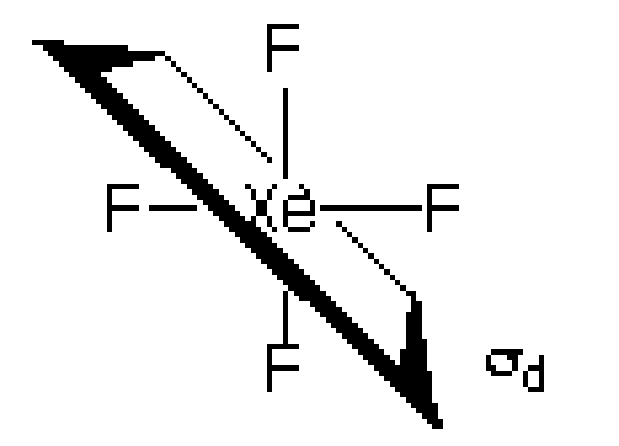
مرکز تقارن
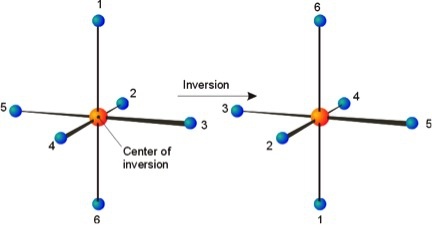
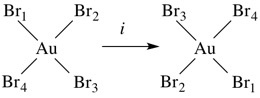
اگر خط مستقیمی از مولکول به مرکز مولکول وصل کرده و آن را در همان راستا و به همان اندازه امتداد دهیم و به اتم مشابهی برسیم، مولکول دارای مرکز تقارن خواهد بود. مرکز تقارن و وارونگی با علامت i مشخص میشوند. به عنوان مثال [AuBr4] یون دارای یک هندسه مسطح مربع در طراف اتم مرکزی Au است و مرکز وارونگی روی اتم Au قرار دارد. در ساختار هشت وجهی مولکول SF6 نیز مرکز وارونگی بر روی اتم مرکزیS قرار گرفته است.
محور چرخشی مرکب
محور چرخشی مرکب حاصل یک عمل تقارنی ترکیبی است. این عمل تقارنی مجموع دو عمل چرخشی Cn و صفحه عمود بر آن یعنی است. عملهای ترکیبی را با حاصلضرب تقارنی مشخص میکنند. نماد محور چرخش مرکب است و به صورت زیر بیان میشود.
چنانجه مولکولی محور چرخشی Cn و صفحه عمود بر آن را داشته باشد محور چرخشی مرکب را هم خواهد داشت. ولی در مواردی مولکول با وجود نداشتن محور چرخشی و صفحه عمود بر آن محور دارند. به عنوان مولکول هشت وجهی منتظم دارای محور S6 و مولکول چهاروجهی منتظم دارای ساختار S4 است. به طور کلی در مواردی که Cn وجود دارد بایستی وجود محور را نیز بررسی کرد.
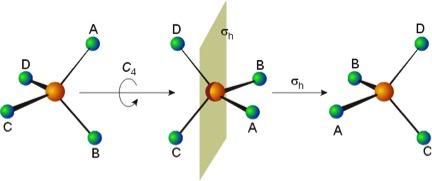
عنصر یکسانی
عنصر یکسانی که با نماد E نمایش داده میشود همان محور چرخشی محض C1 است که شامل چرخش به اندازه 360 درجه است. این عمل تقارنی هر مولکولی را بدون تغییر میگذارد. بنابراین هر سیستمی دارای عنصر یکسانی است (C1 = E) .


سپاس فراوان از زحمات تان
خیلی ممنون .خیلی مفید بود🙏
خواهش میکنم. خوشحالم که براتون مفید بوده.
سلام من sn رو مشکل دارم یعنی روش تشخیص sn که مقدارش چنده رو متوجه نمیشم اگه ممکنه یه توضیحی بدین ممنون
Sn محور دوران مرکب هست که به ترتیب شامل دو تا عمل دوران محض در سیگما اچ هست
محور دوران محض Cn محوری است که حول آن میتوانیم مولکول را بچرخانیم. البته مولکول میتواند چندین محور داشته باشد که محور دوران محض محور دوران اصلی است.
محور دوران مرکب Sn